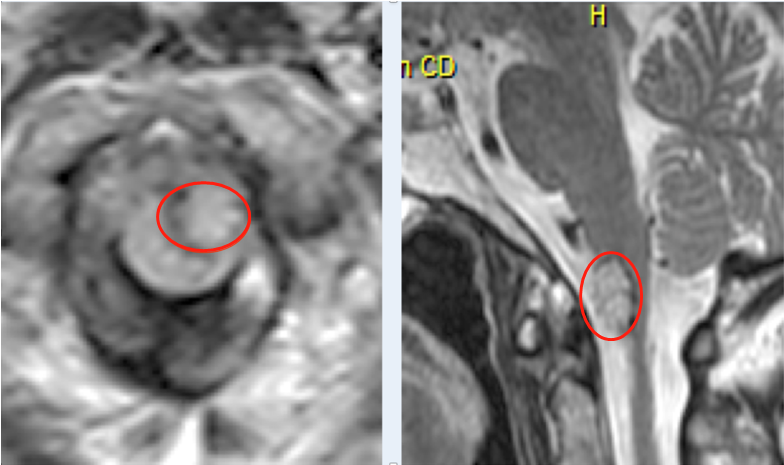
寻找新靶点。
脱靶效应是CAR-T毒性的重要来源。因此,从理论上讲,寻找具有更强特异性和附着力的靶点可以合适降低CAR-T疗法的毒性反应。本文列出了一些特异性靶向胶质母细胞瘤的CAR-T疗法,在临床试验中取得了进展。此外,靶向肿瘤干细胞(cancerstemcell、csc)的CART研究也是一个热点。靶向CSC标志物上皮细胞粘附分子(epithelialladhesionmolecule,epcam)的CAR-T也应用于各种类型的癌症。
对肿瘤相关抗原(tumorassociatedantigen、TAA)靶点的研究也很流行。一些研究人员试图开发靶向肿瘤血管的CAR-T,以控制肿瘤血管的产生,避免TME的免疫控制。其中,Santoro等靶向腺特异性膜抗原(prostatespecificmbrantigen、PSMA)的尝试取得了的成功。
Deng等研究发现,抗肿瘤药物康普瑞汀磷酸钠(combretastatina-4disodiumphosphate、CA4P)也能合适增加CAR-T在实体肿瘤中的渗透。此外,由于肿瘤具有异质性,仅针对已知的几种有限的肿瘤特异性抗原靶点,容易出现耐药性。解决这类问题较有力的方法是通过单细胞测序找到更多的肿瘤特异性靶点,从而避免耐药性和脱靶效应。
组合靶点的应用。
胶质母细胞瘤表面抗原的异质性和正常组织细胞表面少量表达的TAA严重制约了CAR-T疗法的合适性和顺利性,而组合靶点(combinatorial-targeting)的应用提供了的思路。这种方法可以通过布尔电路中的或(OR)门和与(AND)门来理解。或门型CAR-T可以针对两个或两个以上的靶点。任何抗原的信号都可以激活,所以这种CAR-T在面对异质肿瘤细胞时也能起到更好的效果。
Hedge等设计了一种HER-2/IL13Rα2串联CAR,用于治疗胶质母细胞瘤。发现HER-2/IL13Rα2串联CAR在单一抗原刺激下的激活特性与相应的单抗原特性CAR相当。但当肿瘤同时表达上述两种TAA时,可以观察到两个靶信号对T细胞活化的协同作用。与单抗原特异性CAR-T相比,串联抗原受体CAR可以延缓肿瘤在胶质母细胞瘤小鼠模型中的生长,减少抗原逃逸,提高生存率。与门型CAR-T也值得注意。这种CAR-T只有在同时受到两种或两种以上抗原刺激时才能完全活化,可以合适提高CAR-T的特异性,减少对健康组织的损害。
解除免疫控制微环境。
解除TME对CAR-T的限制是该领域的一个热点问题。除了增强CAR-T对TME的抵抗力外,还有一些尝试直接针对TME成分。CAR-T需通过由肿瘤相关成纤维细胞(cancerasociatedfibroblast、CAF)等基质成分组成的物理屏障,才能杀死实体肿瘤癌细胞。因此,CAR-T可能对胶质母细胞瘤有更好的治疗效果。
近年来,也有针对肿瘤基质中硫酸乙酰肝素蛋白多糖(heparansulfateproglycan,HSPG)的尝试。正常情况下,活化的T细胞本身可以表达足够的肝素酶(heparase)来分解细胞外基质,从而渗透组织。但目前CAR-T不同的体外制备过程导致肝素酶表达量下降,分解细胞外基质的能力有限。在神经母细胞瘤异种移植模型中,肝素酶在CAR-T中的表达提高了肿瘤的渗透率和抗肿瘤活性,证明这是好转CAR-T治疗富含基质肿瘤的潜在方法。
对TME中细胞因子的治疗探索实际上是一个更主流的想法。该策略已在使用抗PSMA的CAR临床前试验中得到证实。在PSMA与显性控制的TGF-β受体共同表达的CAR-T上,增殖、细胞因子分泌、抗耗尽、耐久性和抗肿瘤作用增强。在免疫检查点的想法中,Liu试图给CAR-T额外的PD-1-CD28嵌合受体,从而使PD-L1转向共同刺激和激活T细胞。在全部模型中,这种新的受体增强了CAR-T的细胞功能。
探索联合疗法。
在许多减缓T细胞耗尽的尝试中,联合疗法具有良好的实际应用价值。作为两种机制互补疗法,许多研究证明,CAR-T疗法与免疫检查点疗法(immunecheckpointherapy、ICT)的联合应用具有相当大的潜力。还有联合CAR-T疗法和溶瘤病毒疗法的尝试。
Li等在动物实验中发现,RAD.ST(一种靶向TGF-β通道的溶瘤病毒)增强了MDA-MB231异种移植乳腺癌小鼠模型中Meso-CAR-T(一种靶向间皮素,即Mesothelin的CAR-T)的疗效。此外,他们还发现,这种方法可以提高TME,提高TME中IL-6和IL-12的水平。CAR-T疗法和放疗也可能形成协同关系。
Jin和其他研究发现,电离辐射可以增加各种肿瘤组织中IL-8的分泌。因此,利用这一特性,可以增强8R70CAR-T(靶向IL-8CAR-T)向肿瘤区域的聚集,从而提高CAR-T疗法的效果。
优化输注方式
胶质母细胞瘤和淋巴瘤较大的区别在于胶质母细胞瘤有明确的实体病变,淋巴瘤癌细胞分散在全身。在白血病的治疗中,CAR-T疗法的效果不受淋巴细胞归巢率的影响。但在胶质母细胞瘤的治疗中,由于血脑屏障和TME的双重限制,如果采用传统的全身输注方式,注入体内的CAR-T大多难以归巢到患处,疗效会大大降低。局部给药可以合适避免淋巴细胞归巢的不利影响。
CAR-T通过局部注射或手术直接放入患处。局部丰富的CAR-T不仅提高了整体杀伤力,而且节省了CAR-T参与淋巴循环的时间,起效更快。CAR-T疗法效果的提高也意味着剂量的减少,可以避免CAR-T引起的全身不良反应。由于局部直接注射CAR-T可能导致其他顺利问题(如TLS),因此可以利用趋化来提高CAR-T的归巢率。
Craddock等研究发现,在神经母细胞瘤异种移植模型中,CCR2b基因在GD2CAR-T上的表现好转了CAR-T的趋化动力学和抗肿瘤性能。构建小分子药物受体-趋化因子内段CAR,在受影响部位局部注射小分子药物,使CAR-T在趋化作用下沿浓度梯度向肿瘤迁移,可能是提高CAR-T归巢率的温和途径。
预防CRS。
目前,大多数CRS的毒性可以通过大剂量类固醇、血管收缩药、通风支持和支持护理来控制。未来,要进一步降低CAR-T疗法并发CRS的风险,关键是提高CAR-T的组织特异性。只有提高CAR-T的组织特异性,才能在此基础上减少临床用药量,从根本上提高CAR-T疗法治疗胶质母细胞瘤的顺利性。目前,对于其他类型肿瘤CAR-T疗法中的毒性反应,确实有一些有前途的控制方法。
Giordano-Attianese等利用计算机设计了可化学破环的异二聚体(chemicallydisruptableheterdimer,CDH)和用于裂解CDH的小分子。
- 文章标题:治疗胶质母细胞瘤CAR-T的好转措施
- 更新时间:2022-01-06 16:30:08

 400-029-0925
400-029-0925