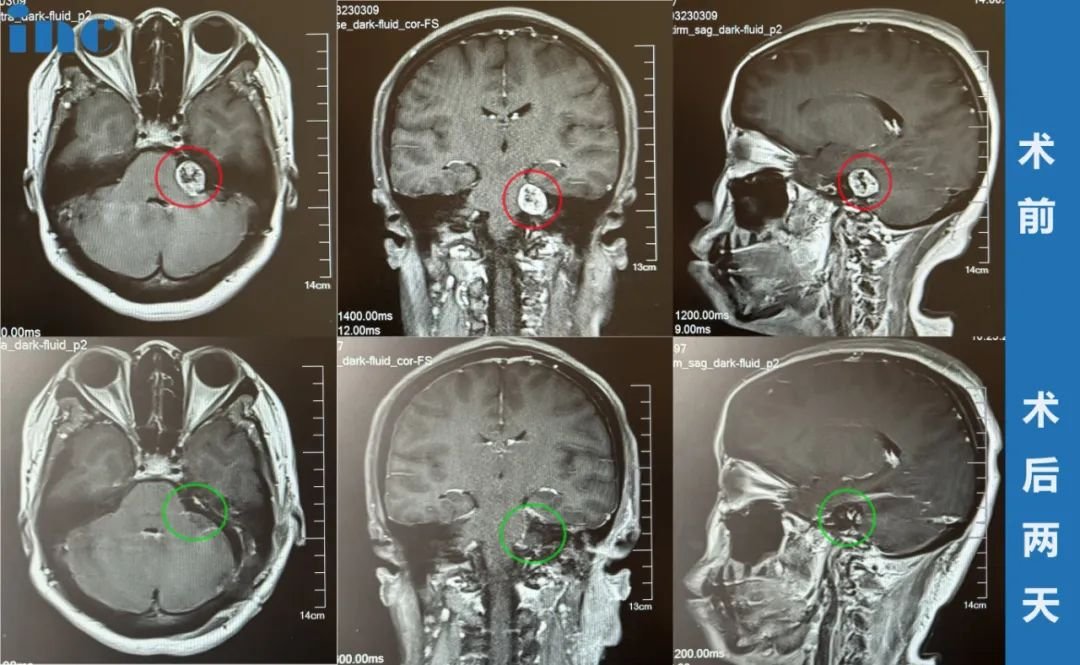
听神经瘤听力保留国内外研究结果?听力重建的方式有哪些?
听神经瘤(vestibular schwannomas, VS)是大多 来源于内听道内的前庭神经雪旺细胞的良性肿瘤, 约占成人桥小脑角肿瘤90%,颅内肿瘤的8%,是内 听道、桥小脑角区域较为常见的良性肿瘤。 VS 多 为散发的单侧发病。 除去散发单侧的 VS,临床上 还有一种更为复杂的情况,即双侧VS。双侧VS是 2 型神经纤维瘤病(Neurofibromatosis type 2, NF2) 的特征表型。该病由22号染色体长臂上的抑癌基 因 NF2 突变导致,属于常染色体显性遗传病,除了 标志性的双侧听神经瘤(可见于 90%-95%的 NF2 患者),同时还伴有皮肤、眼睛及中枢神经系统(脑 膜、脊髓等)的多发肿瘤。
在过去几十年内,听神经瘤的治疗经历了较大 的发展进步。从维持生命、降低致死率到保护面神经功 能,再到保留听力和进行听功能重建的这些转 变(维持生命-保面-保听),也说明了现代医学对 VS 疾 病的认知不断加深,治疗和康复手段都得到了不断丰富。
影像学技术细致化的进展使具有较好听力的小 型VS可以在早期得以筛查和诊断,使得小听神经瘤 病例数量逐渐增多。对于这些具有实用听力的VS 患者群体,具体采用哪些治疗手段仍然存在较大的 争议。单侧VS和NF2相关VS(以下简称NF2-VS) 的基本处理原则是相同的,但由于NF2-VS的肿瘤 生物学特点,也决定了NF2-VS的治疗更加强调神 经功能的合适保留和重建,以及中枢系统严重并发 症的防治。也正因为肿瘤的生长特点,NF2-VS患者 听功能的保留与重建与单侧VS相比,更是挑战中的 挑战。如何个性化方式地保留听力,甚至是如何采 用不同的听觉植入手段重建听力功能,都是耳神经外科、侧颅底外科、耳内镜外科、神经外科、听觉植 入外科专家们共同感兴趣的焦点。
1 临床随访观察(Observation)
对于单侧散发的 VS,临床上可见部分患者的 肿瘤有停止生长的趋势,临床随访观察可以作为一 种听神经瘤可选择的治疗方法(保守治疗)。对于 微小VS,如果没有听力损害或者前庭功能的损害, 临床持续的随访观察是一种值得的方式, 每年一次MRI检查随访。Danish报道了一组932 例的VS患者的长期观察结果,其中249例患者在平 均观察 4.7 年后,仍保持在美国耳鼻咽喉头颈外科 学会分级法 (AAO-HNS) A 或者 B 级的听力水平。 VS 患者随着时间推移,听力存在缓慢的下降趋 势。 只存在于内听道内的 VS,随着随访时间的延 长,10年后的听力保存率只能维持在17%。即使在 较理想的状态下,言语识别率为全切,肿瘤只局限 于内听道内的一组病例中,随访观察10年后,听力 保留率也下降至 73%,言语识别率可以大于 70% 。保守治疗与其他治疗方式相比,在远期的效果如何?Meyer以随访观察的方式,对比其与显微外 科手术在小型VS患者的听力保留效果,结果显示, 显微外科手术可以获得更好的远期听力结果 。
NF2-VS,与单侧 VS 类似,不同病例类型也可 以考虑随访观察。这一策略主要适用于肿瘤较小 (直径<20mm)、生长缓慢(5 年无增长)、无明显症 状或全身情况差的NF2患者,大多数病例可保持观 察耳AAO-HNS A或B级的听力。当观察到肿瘤进 行性生长时,可行显微手术或立体定向放疗 。但 是,对于进展型 NF2-VS,这种随访观察有可能错 过恰当的早期干预时机,当需要进一步处理时往往 瘤体已引起明显听力下降,甚至全聋、面瘫,因为颅 压增高导致视乳头水肿从而双目失明,以及脑干压 迫导致生命危险等严重并发症。因此,NF2-VS 患 者在采用保守治疗时,需要较为慎重,并要密切地 观察肿瘤发展的动态。
2 放射治疗(Radiotherapy)
目前放疗在VS保留听力的治疗领域仍然存在 很多的不确定性。首先,文献上报道的放疗后听力 保留率有很大的差异;其次,不同医疗机构间选用 的放疗适应症和病例入组标准也存在较大差异;采 用的放射源也存在差异,有的采用 Gamma Knife system(GKS),也有采用 Cyber Knife system (CKS) 或者其他放射源;文献报道的放疗后听力保留情况 采 用 的 听 力 评 估 标 准 也 存 在 差 异 ,有 的 采 用AAO-HNS的class A or B, 有的采用 Garner-Robert⁃ son (GR)标准的 grade 1 or 2。这些不确定的因素导 致VS放疗后的听力保留真实合适性很难比较。 Yang 等 总结了 45 篇文献(GKS 治疗 4234 例 患者)的总体听力保留率,建议维持放疗剂量低于 13 Gy,对于 VS 患者放疗后能够保持 AAO-HNS A/ B or GR grade 1/2的听力水平有密切关系。匹茨堡 大学 总结 216 例接受低剂量 GKS 治疗的 VS 患 者,21 个患者接受 12 Gy 放疗量,11 个患者接受12.5 Gy放疗量,184个患者接受13 Gy放疗量,平均 随访 68 个月,其中 106 例放疗前具有 GR class 1 或 者 2 级的听力,放疗后 10 年的平均听力保存率为44.5%。
近十年来,放射治疗单侧散发VS的报道较多, 但关于放射治疗 NF2-VS 的报道较少。 2008 年 Rowe J等 发表了迄今规模较大的一项研究,包括 92 名 NF2 患者(122 例 VS),接受放疗 3 年后,60% 的患者听力明显下降(40%恶化,20%治疗侧出现 全聋),同时面瘫的比率是 5%,且有 2 名放疗后出 现恶变。 我国学者报道,GKS 治疗 5 年后,NF2 患 者总体实用听力的保留率为31.9%,有48%的病例 发展为全聋,有15%保留了双侧实用听力 [19,20] 。 也有学者将放射治疗与显微外科治疗 NF2-VS 的研究进行了系统综述,对比分析了 974 例患者(放疗 485例vs手术489例)的数据,发现显 微手术的听力保存率明显高于放疗(P=0.006),但 面神经功能保留率 SRS 优于手术(P<0.001);局部 肿瘤控制率两者无明显差异(P>0.05)。综上可见, 在NF2-VS患者的听力保留方面,放疗不如显微手 术,但其肿瘤局部控制率和面神经功能保存率较 高。因此,对于特定筛选的 NF2 人群,接受放疗治 疗可能会更加获益 。
3 显微外科手术 (Mirosurgery)
既往文献报道的显微外科手术治疗VS的术后 听力保留的结果差异较大(0%到93%)。手术后能 否保留较好的听力功能与一些因素密切相关。单 纯从手术的疗效而言,与同样大小的散发VS相比, NF2-VS 的听力及面神经功能术后保留效果要差, 手术切除效果亦不佳。这一点与肿瘤的生物学特 点密切地相关,因其更倾向于侵袭周边的蜗神经和 面神经,产生严重的粘连,神经不易分离,不像单发 的 VS 那样多数仅累及前庭神经。 而且,有报道约 59%的NF2病例可同时并发蜗神经和面神经鞘瘤,如在术中不能很好地辨认即会造成术后功能受损。 同时,两者的术后复发率亦明显不同。 15mm 以下的肿瘤全切术后,NF2-VS 的长期复发率在 50%以上,而相应的单侧散发 VS 术后则没有明显 复发。 肿瘤复发会造成该侧听力损失的进行性加 重,而且再次手术粘连更重、难度更大,听力损害甚 至丧失的风险更高 。 以下将重点阐述外科手术 听力保留的几个相关问题。
3.1 肿瘤大小
理论上,肿瘤越小,手术相对越容易,保留听力 的可能性越大。 术后的听力水平如果可以维持在 AAO-HNS A-B 级之间,即认为术后听力保持在实 用水平以上。一些文献数据显示,肿瘤超过 1.5cm 保留听力的可能性小。小型VS(桥脑小脑角内 的肿瘤直径小于 1 或者 1.5cm)的术后听力保存率 在 39%-80%之间。有 报道 VS 直径小于 1cm,其听力保留率可达 45%;如果 VS 直径介于 1-1.5cm 之间,术后听力功能保留率将降至 20%。 也有学者 报道,VS 直径小于 2cm,其听力保留率 可达69.2%;但肿瘤的直径如果大于2cm,听力保留 率只有 40%。 国外Sanna 等 的结果显示,肿瘤的直径 在评估 VS 术后听力保留时很有意义,位于内听道 内的 VS,术后的听力保留率接近 48%。 如果肿瘤 的直径超过1.9cm,听力保留率将降至12.7%。
3.2 内听道底受累与否
如果在颅脑MRI上显示,内听道底外侧无肿瘤 强化影或者存在正常的脑脊液,无论采用乙状窦后 入路还是颅中窝入路进行手术,都存在较好地保持 术后良好听力的可能性。 影像学上,如果内听 道底外侧存在 2mm 以上脑脊液影的 VS,和内听道 底外侧无脑脊液影像的 VS 相比,前者术后实用听 力(AAO-HNS A-B 级)保留率为 60.5%;后者仅能 获得40.0%的术后实用听力保留率,两者有的 统计学差异;两者在术后的残余听力(AAO-HNS C级)保留率也存在差异,前者可以实现近77.6%的 残余听力保留率,后者只有 52%的残余听力保留 率。 有研究报道经乙状窦入路的保留听力的结 果,总体的听力保留率为40.8%。术中肿瘤没有累 及内听道底的病例组,与累及内听道底的病例组相 比,可以获得较高的听力保留率。
3.3 手术入路
通常进行 VS 可以有三种手术入路:乙状窦后 入路、颅中窝入路和经迷路入路。前两者因可保留 耳蜗、前庭及蜗神经而具有保留听力的可能,可以作为保留听力的手术入路。 经迷路入路无法保留 听力,但可保留耳蜗及蜗神经,故可同期或二期行 听觉重建(人工耳蜗植入)。
颅中窝入路被认为特别适合显露内听道底,通 过这个入路能够处理累积内听道底的小型VS。乙 状窦后入路对于充分显露桥脑小脑角更具优势,更 适合处理延伸至桥脑小脑角处的较大的 VS,但乙 状窦后入路的局限性在于显露内听道底不具优势, 需要磨除内听道后唇进行内听道显露,容易损伤半 规管,且术后有发生脑脊液漏的可能性。但由于内 镜技术的应用,使得经由乙状窦后入路处理内听道 底的困难大大降低。国内的学者们在很早也开始了 这方面的有益探索,在VS手术乙状窦后入路中引入 内镜技术,能够观察内听道底肿瘤与面神经的关系、 内听道底肿瘤是否实现全切 [6,9] (图3)。学者们也一 直在探讨颅中窝入路和乙状窦入路在保留听力上的 优劣,在实际临床应用中,如果脱离肿瘤的实际临床 特性去探讨它们的优缺点是较为不客观的。Brack⁃mann 报道 333 例的颅中窝入路 VS 手术术后听力 保留的情况,这些平均直径为 1.12cm 的 VS 患者术 后的听力保留率为59%。Sameshima团队报道的 125例VS患者中,颅中窝入路平均处理直径8.9mm 的VS,获得了76.7%的术后听力保留率;而经乙状窦 后入路所处理的平均直径12.4mm的VS,术后的听 力保留率为73.2%,两者没有统计学的差异。因此, 只有在结合肿瘤大小和所在位置综合考虑时,再比 较两种入路的孰优孰劣才有实际意义。
肿瘤的切除方式也是术后听力保留的重要影 响因素,包括肿瘤的完全切除(total resection)、近全 切除(near total resection)、次全切除(subtotal resec⁃ tion)。 有学者报道,经乙状窦后入路,对于直径 30mm 以下的 NF2-VS,进行肿瘤次全切除的患者 听力保存率达73%,而全切的患者有30%保留了 部分听力 。
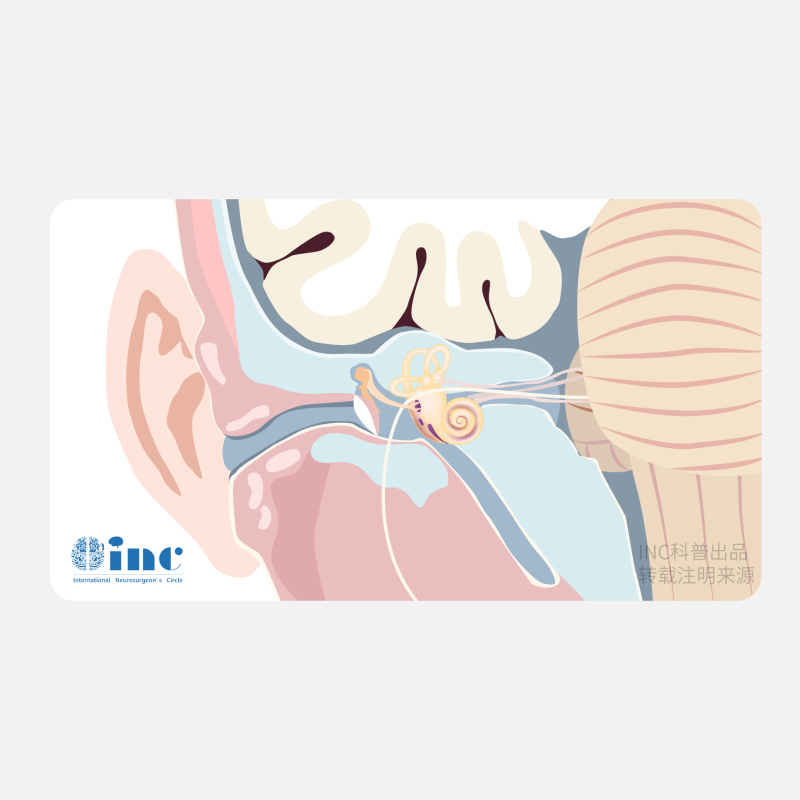
3.4 肿瘤的起源
在内听道内,前庭神经和耳蜗神经的解剖关系 清晰明确。耳蜗神经距离前庭下神经更近,关 系更为密切。处理起源于前庭下神经的VS更容易 损伤耳蜗神经,更容易损伤耳蜗神经的血供。一 些文献也提及,术中探查获知的肿瘤来源可以作为 术后听力保留的评估指标。 前庭上神经来源的肿 瘤,术后有更高的听力保存机率。此外,来源于前 庭上神经的VS的术后言语识别率也可能得到更好 的保护和维持。 前庭上神经来源的肿瘤术后的言语识别率仅下降17.1%,而前庭下神经来源的肿瘤 术后的言语识别率可以下降达 41.6%之多 。
Rachinger也报道了相似的结果,来自前庭上神经 和前庭下神经来源的肿瘤患者组分别获得了 42% 和 16%的术后听力保留率。 当肿瘤起源的评估因 素与内听道底是否受累的因素相结合时,对于术后 听力保存率的评估更有实际意义。如果肿瘤来源 于前庭上神经,且内听道底未被受累,此时保留残 余听力和实用听力的机率分别为93.3%和80%,而 肿瘤来源于前庭下神经和内听道底被肿瘤累及时, 保留残余听力的机率较低 。
3.5 术中判断听力保留状态的手段
ABR 在术前可以作为评估残余听力水平的有 效判断手段,已经在临床中被广为应用。 对于 VS 保留听力的外科操作来说,术中实时的 ABR 听力 监测不但是可以作为保驾护航的预警手段,还成为 评估术后听力保留情况的评估方式。在VS手术关 闭术腔的过程中,ABR的V波存在可以提示术后听 力得到较好的保存。 Phillips 报道在其 57.5%的 VS 患者中保留了术后的实用听力,而其中保留了 术后听力的患者中,有77.8%的病例在手术的结束 时显示了ABR 的V波存在。2003年解放军总医院 耳鼻咽喉头颈外科采用复合动作电位监测 (Compound action potential,CAP)进行 VS 手术术中 的听力监测,也同样可以实现术中实时的听功能反 应,临床应用效果更为理想 ,CAP 的 AP 波波幅对 术中血管的骚扰反应比较敏感,实时的 AP 波幅下 降可以提示术者手术操作或者起到预警作用,术闭 时AP波的存在也可以预示残余听力的保留。
4 靶向治疗(Targeted Therapy)
单侧散发VS很少有药物治疗合适的报道,但针 对NF2的药物治疗已经有重要突破。贝伐单抗是目 前被临床治疗NF2的靶向药物。该药是重组的人源化单克隆抗体,可与血管内皮生长因子 (VEGF)相结合,通过控制VEGF的生物学活性(血 管生成、血管通透性)而起到抗肿瘤的作用。前期研 究发现VEGF及其受体VEGFR-1表达于前庭神经 鞘瘤中,它们的表达水平与肿瘤生长速度密切相关。 因此,人们开始尝试将其用于 NF2 的治疗。 2009年,杂志NEJM发表了贝伐单抗治疗NF2 的结果,10 名 NF2-VS 进行性生长的听神经瘤患者使用贝伐单抗后,有6名患者获得了影像学响应, 即VS肿瘤体积缩小超过20%。其中4名患者获得 了客观听力响应,即言语识别率明显增加。此后的 多项研究证实,在进展型 NF2 患者,贝伐单抗可使 50%的患者听力获得提高、肿瘤体积缩小,且几乎没 有出现听力恶化的病例。近期一项开放临床试验II 期研究报道,36%的NF2患者获得了客观听力响应 (言语识别率明显提高),这其中又有约60%的人在 停药半年后依然保持着他们治疗所获得的听力响应 (言语识别率)。而给予小剂量(减半)、长时程的贝 伐单抗治疗,NF2-VS患者可实现肿瘤长达76个月 的稳定不生长。因此,由于在保留听力、控制肿瘤 方面的疗效,贝伐单抗是目前被公认用于VS进 展型NF2的药物。但是,靶向治疗的长期效果和副 作用还是需要关注,期待发现或研发针对NF2的更 加合适和低副作用的靶向药物。
4.1 VS的听觉重建策略
如果 VS 术中无法实现患侧的听力保留,且对 侧耳也没有通过助听装置来好转交流的实用听力 水平,则需评估进行听觉植入来实现患者的听 力重建,这对确定患者术后的生活质量是较为重要 的 。一般而言,单侧听力下降患者很少有助听补 偿的强烈需求,但双侧听力下降的听神经瘤则有迫 切需求听力重建。目前,听力重建的主要手段是以 人工耳蜗(cochlea implantation, 人工耳蜗)和听觉脑干植 入(auditory brainstem implantation, ABI)为代表的 听觉植入技术。有学者将助听器亦归入听力重建 的手段之一,包括BAHA或骨导助听装置等 。助 听器主要起到声音信号放大的作用,但是NF2患者 属于双侧病变且为蜗后聋,言语识别率的下降甚至 比纯音听阈更明显,因此助听器对于此类患者的效 果往往很有限,而且多数患者因为同时放大的环境 噪声而拒绝佩戴。
4.2 人工耳蜗植入(cochlea implantation)
2003年Ahsan 一次报道了NF2患者在同侧同 期进行经迷路VS手术和人工耳蜗手术的病例,。2005年Aristegui 一次报道了散发单侧的听神经瘤经迷路 入路进行VS手术时,在同期同侧进行人工耳蜗手术的病 例,术后获得了良好的效果。后续也出现了一些非 大宗的VS手术同期同侧行人工耳蜗的病例报道,但均以 NF2 病例为主,散发的 VS 患者进行肿瘤切除同时 进行人工耳蜗的病例数并不多。但是对于有必要进行听觉康复的单侧散发 VS 病例,行经迷路入路进行肿 瘤切除后同期进行 人工耳蜗 手术,已经被证实为可行而 且合适的听觉康复手段。
对于那些行肿瘤切除且保留耳蜗神经的 NF2-VS 患者,如何评估能否进行一期 人工耳蜗,尚无确 切可靠的方法。 目前,术中利用电生理监测(如 EABR、ABR、CM 等),在鼓岬表面或圆窗处放置刺 激电较,收集来自蜗神经、或者耳蜗背侧核、甚至更 高级中枢的反应信号,以评估神经功能,将有助于 评估人工耳蜗术后的效果。关于VS手术入路,文献报道 均以经迷路入路为主,经迷路入路手术可以更好地 暴露蜗神经,肿瘤切除和 人工耳蜗 手术可以在同口 和视野内完成 。另外,为了较大水平地确保听神 经的完整性,也可在不切除肿瘤的情况下,直接行 人工耳蜗,但只适用于肿瘤较小、稳定无生长的患者。 针 对这个问题,国际各国的标准不尽相同。 通常认 为,对于双侧VS均稳定无明显生长的NF2患者,较 佳助听状态下,较大 SDS 小于 50%、BKB (Bam⁃ ford-Kowel-Bench sentence) 语句评分低于 50%时, 建议行 人工耳蜗 植入。 从现有研究结果看,与一般的耳 聋人群相比,NF2 患者的 人工耳蜗 效果参差不齐、个体差 异很大,这主要源于蜗后病变所致的神经功能障碍;人工耳蜗 仅适用于小部分 NF2 患者,但是对于经过筛 选的适宜病例,人工耳蜗可以好转听功能,甚至成为 比ABI更为合适的重建手段 [53] 。
4.3 听觉脑干植入(auditory brainstem implantation, ABI)
当切除肿瘤的同时不能保留耳蜗或者耳蜗神 经的功能时,ABI 就成为 NF2-VS 患者重建听力的 方法。 欧洲很多大型医学中心开展 ABI 手术 较为普及,具有丰富经验,但 ABI 手术植入在我国 开展很少。 ABI 技术的原理是绕过无功能的耳蜗 和耳蜗神经节点,直接将电较植入至听觉通路更高 层面的脑干耳蜗核复合体,从而建立新的听觉通路。ABI植入成功的关键在于需要准确定位耳蜗 神经核。手术时,可以采用乙状窦后入路或经迷路 入路来完成。 ABI 植入体的类型也可以有多种选 择,常用的包括 Cochlea 公司 22 导和 24 导 ABI、 MED-EL 公司 40+ ABI 等,它们的总体植入效果接 近。相关研究的 Meta 分析提示,植入后的平均 使用率为 86.8%,平均单词得分 ABI+唇读和单纯ABI 分别为a72.9%和 35.3%,平均语句得分则分别 为 57.7%和 12.3%,获得开放式言语识别的患者比 例为11.6% 。尽管ABI的听力康复效果明显不如 人工耳蜗,它仅可以在很少的患者中实现开放式言语识 别,但大多数的患者开机后在安静环境下可以配合 唇读来获益。 而且,随着使用时间的延长,ABI 植 入后的听觉效果有可能不断好转,经过数年训练后 其言语识别率会持续提高,ABI术后康复的这种过 程与人工耳蜗明显不同。
近30年来,ABI已成为对双侧听神经瘤伴双侧 较重度耳聋患者进行听力重建的重要手段,也是唯 一的选择。 对于对侧耳有实用残余听力的患者, ABI 与 人工耳蜗 相比,似乎不能提供更多的听觉感知,甚至不能给患者提供听力帮助。据文献报道 ,1 名接受ABI的NF2患者主诉:当对侧耳有实用听力 时,ABI 会干扰其对侧耳的言语识别;但是当对侧 耳听力丧失时,ABI可提供很好的听力帮助。当对 侧耳存在实用听力时,ABI电刺激产生的人工听觉 将影响双耳信号在听觉皮层的同步性。因此,也有 报道当切除 NF2-VS 患者单侧肿瘤并一期行听觉 植入时,术后将设备关闭,直到患者双侧听力均丧 失时方开机 。 一般而言,当患者年龄较大、肿瘤 为中小型、生长缓慢或无明显生长时,可在不切除 肿瘤的情况下直接行人工耳蜗;而对于年轻患者、肿瘤较 大且进行性生长时,建议在肿瘤完全切除的基础上 一期行ABI植入 。
综上所述,国内外手术团队的听神经瘤听力保留率有所不同且还是需要很大进步的,无论是散发的 VS 还是 NF2-VS,为 了实现残余听力的保留,治疗策略可以有多种选 择,对于单一病例的治疗也可以是个性化的,尚无 统一的标准。一些VS患者适合选择非外科干预手 段,例如保守观察随访、放疗、甚至是药物治疗来维 持实用听力水平,但通过外科干预来保留听神经瘤 患者的残存听力、进行听力重建仍然是满足听神经 瘤患者较大的听力需求较为重要的手段,仍然具 挑战性。一些VS病例的听力保留和听觉功能重建 术后的效果仍然不够理想,还有许多问题尚待解 决。由于听神经瘤包括NF2缺乏理想动物模型,所 以其确切的发生机制、针对性的药物研发和各种干 预手段效果的客观评价等研究在国内外都还是空 白。期待未来能有更多的理念和技术手段不断涌 现,可以让更多的患者受益。
国际听神经瘤手术教授介绍

巴特朗菲所在的德国国际神经科学中心INI医院1978-1993年期间的1000例听神经瘤手术结果就已达到了大概率的病人肿瘤全切,93%面神经保留率,63%的听神经功能保留,随着各种神经监测技术进步 ,现德国INI医院的Samii和Bertalanffy团队,听神经瘤手术更是高达大概率病人肿瘤全切同时面听神经高达90%的保留率。
参考文献:听神经瘤之听力保留策略和听力重建技术.中华耳科学.2020
- 文章标题:听神经瘤患者听力受哪些因素影响?如何保护及重建听力?
- 更新时间:2021-03-23 13:57:39

 400-029-0925
400-029-0925