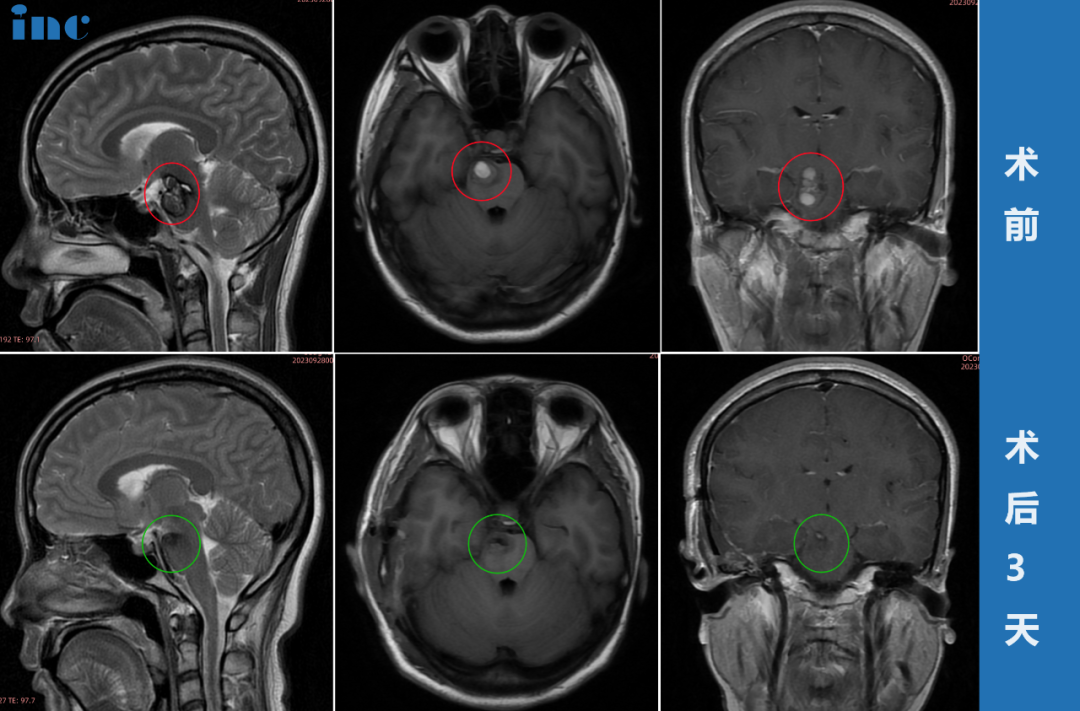
Eph及配体ephrin在胶质瘤的作用,Eph及配体ephrin在胚胎发生和发育中是一个重要角色,通常高表达于神经和内皮细胞,且其信号主要调节胚胎发育过程中神经嵴细胞迁徙、轴突导向以及神经血管生成。实际上Eph及配体ephrin目前几乎在全部组织中,调节复杂的发育过程(如细胞黏附、轴突导向、细胞迁移、细胞分类、血小板聚集等)。例如,Eph及配体ephrin参与建立听觉系统的神经元发育,并引导皮质层树突延伸和成熟。但Eph及配体ephrin表达在病理状态下、损伤和成年期恶性肿瘤中亦有改变。
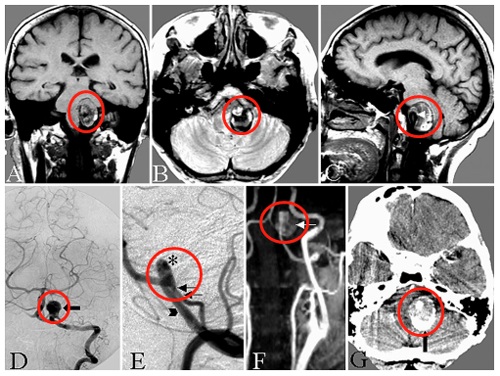
在胶质瘤发生和发展中,Eph及配体ephrin蛋白异常表达水平,往往与较高肿瘤分级和预后不良相关。Eph及配体ephrin定位在肿瘤细胞、肿瘤血管、胶质瘤细胞浸润的脑组织和免疫细胞浸润的肿瘤表面。由于相邻肿瘤细胞和肿瘤微环境可产生互相作用,Eph及配体ephrin可以通过促进或控制肿瘤发生而发挥作用,这取决于下游产生的是正向或反向信号。上述特点使得Eph/ephrin系统在胶质瘤治疗新策略中成为一个有吸引力的候选对象。
1 EphA/ephrin-A相关研究
在EphA/ephrin-A蛋白中,EphA2和ephrin-A1与胶质瘤生物学间的关系报道较多。EphA2在不同肿瘤中高度表达,包括乳腺癌、卵巢癌、胃癌、胰腺癌和腺癌,这提示EphA2是许多肿瘤的共同癌蛋白。EphA2在约60%胶质母细胞瘤中过度表达,也在星形细胞瘤中高度表达且随病理分级增高而表达明显增强,其过度表达与病人不良预后直接相关,与病人存活率成反比。
EphA2过度表达不仅可出现在肿瘤细胞中,还可出现在具有血管高密度的GBM区域,以及内皮细胞包绕的GBM区域,这提示EphA2参与肿瘤血管形成;虽然EphA2过度表达,但在胶质瘤组织中很少有ephrin-A1表达。
由于GBM中ephrin-A1配体低水平表达,EphA2尽管过度表达但仍处于非生物活性状态。与此相矛盾的是,在胶质瘤中起控制增殖、侵袭作用的EphA2激酶是由ephrin-A1激活。因此,ephrin-A1有肿瘤控制作用。然而,如果长期给予外源性ephrin-A1刺激,可导致EphA2受体和点状黏附激酶(FAK)下调,从而导致增殖和迁徙能力下降。Ephrin-A1所致EphA2下调是由EphA2/ephrin-A1复合体的内吞作用造成。Ephrin-A1在GBM低表达部分解释EphA2活性缺乏和过度表达。在体外和体内实验中,发现EphA2/ephrin-A1相矛盾的表达情况,提示ephrin-A1与EphA2间存在相互控制的环路。在检测其他EphA与胶质瘤病人预后的关系中,EphA7可染色肿瘤细胞血管内皮细胞,但不染色周围结缔组织。其可作为一种新的胶质母细胞瘤预后标志物。在约45%GBM样本中,EphA7过度表达并预示GBM病人不良预后。此外,通过半定量PCR,检测到EphA5在正常脑组织中表达,但在低级别胶质瘤标本中表达降低,在高级别胶质瘤中进一步降低。这个结果表明:EphA5表达下降程度可作为胶质瘤进展情况的标志物,也同时突出EphA5作为肿瘤控制基因的作用。
2 phB/ephrin-B相关研究
在EphB/ephrin-B信号途径中,ephrin-B2被看作是恶性星形细胞瘤短期存活的一个预后指标,ephrin-B2高表达的肿瘤病人存活率低于低表达者,EphB4/ephrin-B2表达增加与胶质瘤病理分级呈现依赖性,且表达水平与胶质母细胞瘤病人无进展生存期相关。胶质瘤中EphB2、B3和B4表达水平均高于正常脑组织,EphB1表达不随胶质瘤病理分级而变化。通过Kaplan-Meier生存曲线分析,EphB1高水平表达者相比于EphB1低水平表达者,有着延长的存活期,这提示EphB1高表达与良好预后相关。
研究表明:EphB1以配体依赖的方式控制胶质瘤细胞侵袭,且EphB1可作为胶质瘤预后的阳性指标。
- 文章标题:Eph及配体ephrin在胶质瘤的作用
- 更新时间:2021-11-10 16:20:58

 400-029-0925
400-029-0925