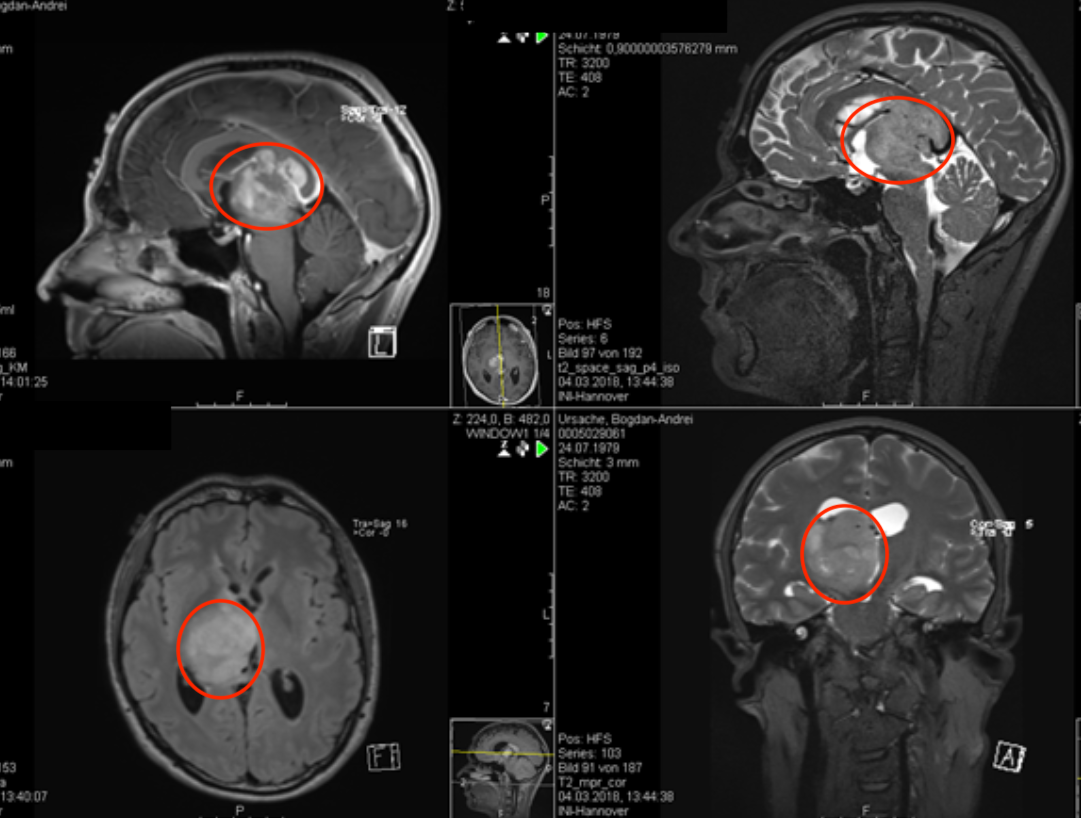
神经胶质瘤细胞内有大量的异常代谢现象:
①能量代谢异常。在氧气充足的情况下,肿瘤细胞更倾向于引发糖酵解,即Warburg效应,表现为酶解活性,乳酸生成增加。Warburg效应能补充肿瘤细胞的生产能力,为肿瘤细胞增殖提供大分子物质前体,是肿瘤细胞增殖、侵袭的基础。神经胶质瘤中的异柠檬酸脱氢酶1(isocitratedehydrogenase1,IDH1)和丙酮酸激酶M2(pyruvatekinaseM2,PKM2)过度表达引起的能量代谢异常对DNA甲基化和组蛋白修饰有影响。
②叶酸代谢不正常。神经胶质瘤中缺少叶酸和四清叶酸还原酶(fourcleanredductasesubunit,MTHFR)的基因多态性会降低代谢酶的活性,从而减少DNA甲基化。后生是一种改变基因表达的现象,而不改变核苷酸序列,包括DNA甲基化和组蛋白修饰等。IDH1基因突变导致的DNA甲基化升高控制了胶质瘤的分化,增殖,而由于叶酸代谢异常导致DNA甲基化导致胶质瘤的发生.发展;另外,PKM2入核调节组蛋白H3T11磷酸化,促进基因转录和增殖。后遗传学对胶质瘤的发生、发展具有重要意义,为胶质瘤的治疗提供了新思路。
1.2-羟基戊二酸(2-hydroxy-glutaricacid,2-HG)对DNA甲基化有影响。
IDH1蛋白是人体内三羧酸循环的关键酶,超过70%的IDH1基因突变可见于WHOⅡⅡ型星形细胞瘤和少突胶质细胞瘤,其预后优于野生型。IDH1基因突变.MGMT基因甲基化、1p/19q等为分子标记,可更好地指导临床治疗和预后判断。结果显示,CpG岛甲基化水平与IDH1基因突变有较强的相关性。
结果发现,突变的IDH1R132H基因与已突变的IDH1R132H基因的结肠癌细胞系有很大的相似性,其CpG岛甲基化表现与IDH1基因突变胶质瘤相似。IDH1基因突变引起CpG岛甲基化的机理为:①2-HG能与DNA脱甲基酶TET家族的DNA羟化酶相竞争,通过5-hydroxymethycytosine,5hmc,5hmc,5-hmc,产生中间产物5羟甲基苷,DNA甲基化水平增加。生化实验表明:IDH1基因突变对TET蛋白的活性有明显的控制作用。结果表明:在胚胎干细胞TET1和TET2基因敲除后,5hmc水平明显下降,DNA甲基化明显下降;表达IDH1R132H基因突变的星形细胞系控制TET2蛋白依赖性。其中5hmc是一种稳定的表观遗传标记,可以直接调节基因组结构和功能,调节基因表达。提示IDH1基因突变通过2-HG控制TET蛋白,引起5hmc的降低和DNA甲基化的增加,从而调节基因表达。②2-HG控制组蛋白去甲基酶,组蛋白甲基化促进DNA甲基化。人类外酶活实验表明:2-HG对组蛋白去甲基化酶KDM较为敏感,说明KDM可作为2-HG和IDH1两个基因的靶点。
结果表明:KDM2对组蛋白H3K36me1和H3K36me2的脱甲基化作用,在转染突变的IDH1R132H基因U87细胞中发现H3K9me2.H3K4me3.H3K79me2增加。结果表明,组蛋白H3K9在DNA甲基化前发生三甲基化作用,提示组蛋白甲基化可能会促进DNA甲基化,从而导致组蛋白甲基化。结果表明:IDH1基因突变的神经胶质瘤患者预后较好,可能与突变后DNA甲基化增加有关,例如IDH1基因突变的胶质瘤细胞中乳酸脱氢酶启动子甲基化增加,通过对细胞糖酵解的控制,使细胞增殖减慢、凋亡增多;经IDH1R132H突变基因转染后,H3K9甲基化及巢蛋白表达水平升高,胶纤维酸性蛋白表达降低,控制细胞分化。
PKM2入核调节组蛋白磷酸化。
PKM是一种与丙酮酸生成和ATP生成有关的糖酵解途径的关键酶。PKM1主要表达分化成熟细胞,而PKM2则在肿瘤细胞重激活。肿瘤细胞中PKM2表达较高,并增强了Warburg效应,促进胶质瘤的生长,PKM2敲去胶质瘤细胞的存活率。另外,PKM2的入核作用还能发挥其蛋白激酶活性,以H3和信号转导.signaltransducerandactivatoroftranscription3,STAT3)作为一种磷酸化组蛋白的底物,影响基因转录和染色质重构,在调节基因的表观遗传变化中发挥重要作用。
PKM2与核蛋白a5结合进入核内,与组蛋白H3相互作用,磷酸化组蛋白H3T11位点被磷酸化后,进入核内。使组蛋白脱乙酰化酶从细胞周期素D1(cyclinD1,CCND1)和C-MYC癌基因启动子区分离,PKM2与B-连环蛋白结合形成复合物,这两种蛋白在CMYC癌基因和CCND1基因启动子区之间形成酪氨酸乙酰化反应。增加C-MYC和CCND1基因转录与蛋白表达,促进细胞增殖。Yang等实验证实:PKM2在表皮生长因子刺激下,在胶质瘤细胞核内聚集,核内PKM2通过影响表观遗传促进C-MYC、CCND1基因转录及肿瘤增殖。Gao等研究表明,核内PKM2.丝裂原激活蛋白激酶5(mitogen-activatedproteinkinasekinase5)MEK5)与细胞增殖有关,MEK5在PKM2促进细胞核内PKM2的增殖中发挥重要作用。结果表明,STAT3蛋白与MEK5基因的启动子区相结合,直接激活MEK5基因转录,导致MEK5蛋白高表达,促进肿瘤发生、发展。
PKM2在胶质瘤中的高表达不仅增强了Warburg效应,而且可以通过入核调节组蛋白磷酸化,促进细胞增殖,并从G1期转到S期,对肿瘤增殖有促进作用,与临床分期及预后密切相关。
3.叶酸代谢异常影响DNA甲基化。
在体内,叶酸是一碳单位的载体,参与体内一碳单位的转移、氨基酸代谢及甲基化过程。叶酸代谢异常可引起DNA甲基化,影响DNA稳定性,促进肿瘤发生和发展,补充叶酸则能控制肿瘤细胞的增殖,增强其对替莫唑胺的敏感性。叶酸为S-腺苷甲硫氨酸(s-adenosylme-thionine,SAM)的合成原料,叶酸缺乏会导致SAM的产生和基因组甲基化水平降低,从而导致肿瘤发生。在大鼠体内缺乏叶酸,DNA甲基化程度较低。Liu等研究发现,神经胶质瘤患者组的血浆中叶酸水平明显下降,提示叶酸缺乏可能通过某种机制影响基因甲基化,从而导致肿瘤的发生。
MTHFR蛋白是合成SAM的关键酶,MTHFR基因多态性降低和合成SAM的能力降低,导致基因甲基化和基因组不稳定。结果表明:在高等别胶质瘤患者中,携带基因型677TT的患者明显多于对照组,而且在叶酸缺乏的情况下,DNA甲基化水平明显下降。Liu等研究发现,基因型为677TT的脑胶质瘤患者叶酸代谢负平衡,MTHFR与MGMT低甲基化有关。还有研究指出:MTHFRC677T基因型可引起该酶活性的降低和基因甲基化的减少,加速了胶质瘤的发生。Cartron等研究发现,叶酸的体内和体内的补充可以引起血小板源性生长因子(platelet-derivedgrowthfactorB,PDGF-B)基因的子甲基化。Zhou等用叶酸可以诱导PDGF-B基因启动子甲基化,并控制胶质瘤细胞的增殖。
- 文章标题:神经胶质瘤表观遗传代谢异常。
- 更新时间:2021-11-09 13:40:12

 400-029-0925
400-029-0925