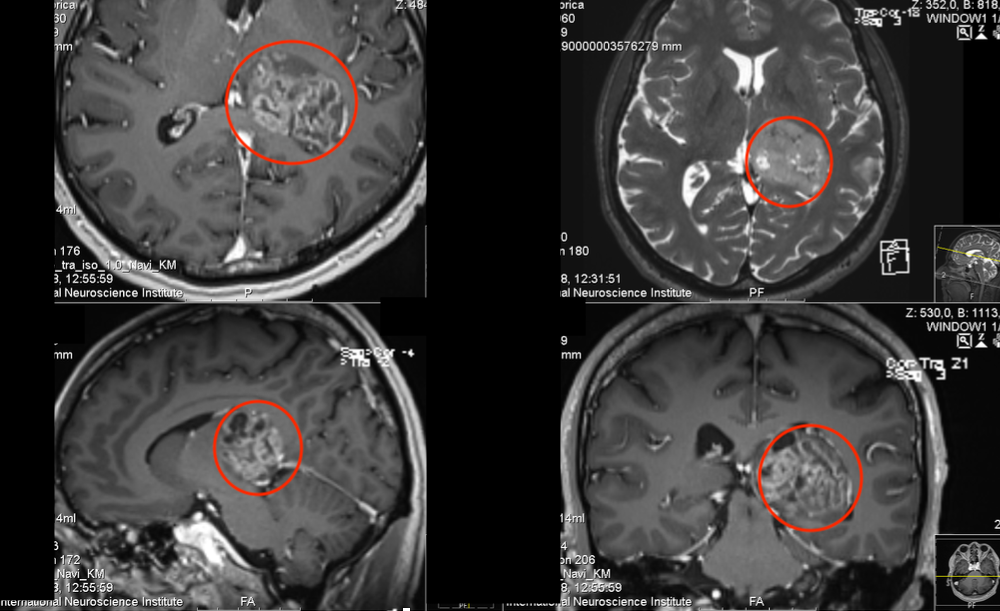
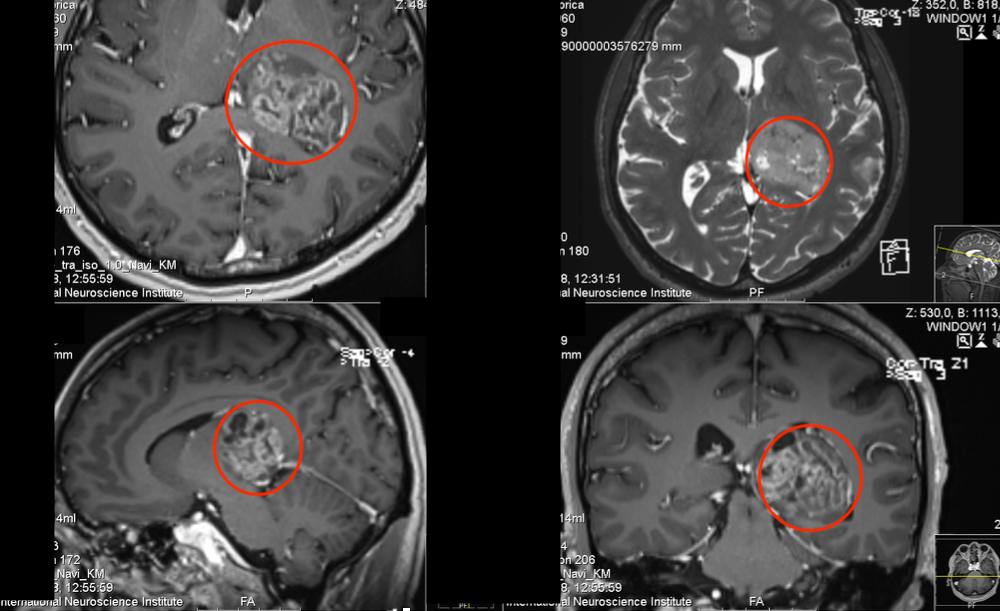
脑胶质瘤中髓源性控制细胞的表现及特征。近年来,免疫治疗在实体瘤中的研究和应用备受关注,其中肿瘤诱导的免疫控制在免疫治疗中起着重要作用。髓源性控制细胞作为一种控制性免疫细胞,也影响着胶质瘤的发生和发展。目前的研究表明,髓源性控制细胞通过高表达精氨酸酶-1(arginase1、ARG-1)、诱导一氧化氮合酶、活性氧等方式增加了各种肿瘤患者的外周血和肿瘤组织的表现。,诱导免疫控制因子(如IL-10)的分泌和调节性T细胞(Tregulatorycels、Treg),从而控制身体的抗肿瘤作用,促进肿瘤的进展。中枢神经系统中的血脑屏障可以在程度上限制外周血液中髓源性控制细胞渗透到胶质瘤中,但髓源性控制细胞在胶质瘤中仍然起着重要的免疫控制作用。
髓源性控制细胞在胶质瘤患者外周血和肿瘤组织中的表现差异
GIELEN等研究表明,胶质母细胞瘤(Glioblastoma、GBM)患者血液中的M-髓源性控制细胞和PMN-髓源性控制细胞明显高于健康对照组,胶质瘤细胞悬液中的髓源性控制细胞完全由CD15+PMN-髓源性控制细胞组成;MOYES等研究发现,CD15+细胞主要分布在血管周围;这也在程度上反映了髓源性控制细胞可以通过血脑屏障从血液渗入肿瘤组织。另一项研究表明,GBM中82%为CD14-CD15+PMN-髓源性控制细胞,其次是Lin-E-髓源性控制细胞(15%)和髓源性控制细胞(3%)。
在GBM患者的外周血液中,髓源性控制细胞仍以PMN-髓源性控制细胞为主,具有较高的T细胞控制能力。外周血和肿瘤组织中髓源性控制细胞的含量和亚型存在差异:一方面,由于髓源性控制细胞不同亚型的构象差异,血脑屏障的通过率可能不同;另一方面,髓源性控制细胞的不同亚型可能不同程度地受到肿瘤细胞分泌的细胞因子和趋化因子的控制。
脑胶质瘤中髓源性控制细胞的渗透和聚集
肿瘤微环境中有多种细胞因子和趋化因子,不仅可以作用于肿瘤细胞,还可以直接或间接影响肿瘤微环境中免疫细胞的渗透和聚集。CC趋化因子-2(C-CChemokineligand2、CCL-2)作为趋化因子,可以通过来源于肿瘤的CCL-20和骨保护素诱导小胶质细胞和巨噬细胞的分泌,并通过CCR4和CCR2招募M-髓源性控制细胞参与胶质瘤微环境的免疫控制。
研究表明,CCL-2的表达水平与患者的总生存期和胶质瘤的恶性程度相关,这进一步证明了CCL-2在髓源性控制细胞肿瘤浸润过程中起着重要的调节作用。此外,半乳糖凝集素1(Galectin1、Gal-1)作为胶质瘤细胞分泌的细胞因子之一,参与先天性和适应性抗肿瘤免疫过程。BAKER证实,与表达Gal-1的GL261胶质瘤相比,未表达Gal-1的肿瘤组织中髓源性控制细胞的渗透水平增加了约7倍,可诱导大量自然杀伤细胞渗透到肿瘤组织中,发挥抗肿瘤作用;髓源性控制细胞渗透主要发生在早期Gal-1缺陷的胶质瘤中。
除了肿瘤微环境中的细胞因子和趋化因子调节髓源性控制细胞浸润外,LIAO认为外源因素(如地塞米松)还可以促进髓源性控制细胞渗透到胶质瘤组织中,提高髓源性控制细胞的控制活性;但也有学者认为地塞米松与髓源性控制细胞肿瘤浸润无关,没有发现地塞米松的治疗时间影响钙结合蛋白S100A8/9或精氨酸酶的表达。这种差异可能是由于地塞米松对髓源性控制细胞浸润的调节与肿瘤恶性程度有关。
研究发现,地塞米松在WHOI级胶质瘤和GBM组织中比非肿瘤性脑组织和WHOII~II级胶质瘤更能促进髓源性控制细胞渗透到肿瘤中。这些结果表明,地塞米松可以在程度上促进髓源性控制细胞在血液中的聚集和渗透到肿瘤组织中,并与肿瘤的恶性程度有潜在的相关性。然而,髓源性控制细胞中地塞米松的分化、迁移和渗透的具体机制需要进一步研究。
脑胶质瘤中3髓源性控制细胞的免疫控制功能
肿瘤免疫逃逸的机制之一是肿瘤微环境中髓源性控制细胞的扩张。深入了解髓源性控制细胞的免疫控制功能,可以为进一步开展免疫治疗提供前提和基础。发现肿瘤来源的CD4+效应记忆T细胞可以高水平表达程序性细胞死亡蛋白1(programedcelldeathprotein1、PD-1),其配体PD-L1在胶质瘤相关PMN-髓源性控制细胞上的表现也明显提高;这表明PMN-髓源性控制细胞可能通过参与PD-1/PD-L1免疫检查点控制机制阻碍T细胞增殖,并在GBM中发挥免疫控制功能。
胶质瘤干细胞样细胞高水平产生巨噬细胞迁移控制因子(macrophagemigratinhibitoryfactor,MIF),并可通过受体CXCR2依赖增加髓源性控制细胞中ARG-1的表达,减少瘤内细胞毒性T细胞(cytotoxictlymphocyte,CTL)的渗透,从而降低CTL对肿瘤细胞的杀伤作用。与此同时,研究证实,血液来源PMN-髓源性控制细胞是目前表达ARG的主要细胞群,对T细胞功能有很强的控制作用。此外,CD124还可以介导IL-13诱导髓源性控制细胞产生ARG,通过IL-4Ra依赖控制T细胞增殖,从而实现髓源性控制细胞介导的免疫控制。因此,血浆中ARG-1和粒细胞聚落刺激因子(granuloloystingfactorator,G-SCSARARacracragragragragemintintintory)的升高水平可能对促进髓源性控制细胞控制因子的功能起到重要作用,从而产生免疫控制作用。
研究表明,使用环氧化酶-2(cycloxygenase-2,COX-2)控制剂可以控制腺素2(PGE2)的产生,从而减少肿瘤微环境中髓源性控制细胞的扩增,髓源性控制细胞扩增减少的效果与肿瘤微环境中CXCL-10和CTL的增加是一致的。因此,髓源性控制细胞可以通过参与COX-2-PGE2来限制肿瘤中CTL的渗透,从而在胶质瘤细胞的发育中发挥免疫控制作用。
综上所述,髓源性控制细胞作为肿瘤微环境中免疫控制细胞的亚群,通过参与多种方式控制T细胞活性,从而促进肿瘤细胞的免疫逃逸过程。因此,通过干预或解除髓源性控制细胞的功能,必然会在程度上为免疫治疗奠定疗效基础。
靶向髓源性控制细胞脑胶质瘤免疫治疗
在胶质瘤免疫微环境中,髓源性控制细胞在多种因素的作用下聚集活化,控制机体的抗肿瘤免疫功能,参与肿瘤免疫逃逸;因此,直接或间接靶向髓源性控制细胞的免疫治疗可能会为胶质瘤的免疫治疗提供新的思路。由于胶质瘤干细胞样细胞产生的MIF可以通过受体CXCR2的依赖增加髓源性控制细胞中ARG-1的表达,减少肿瘤中渗透的CTL。使用MIF控制剂萝卜硫素时,可控制正常CD14+单核细胞向髓源性控制细胞的转化;因此,MIF可以减少肿瘤中渗透的髓源性控制细胞,增加肿瘤中的CTL渗透,从而发挥抗肿瘤作用。
此外,研究表明,通过减少肿瘤组织中的Gal-1表达,可以减少肿瘤浸润的髓源性控制细胞,延长荷瘤鼠的生存期;COX-2通道促进髓源性控制细胞扩张及其在肿瘤微环境中的积累,限制CTL的肿瘤浸润,促进胶质细胞的发育;趋化因子CCL-2可以通过CCR4和CCR2筹集M-髓源性控制细胞浸润肿瘤,这在动物实验中得到了证实。
- 文章标题:脑胶质瘤中髓源性控制细胞的特征
- 更新时间:2022-01-14 14:51:35

 400-029-0925
400-029-0925