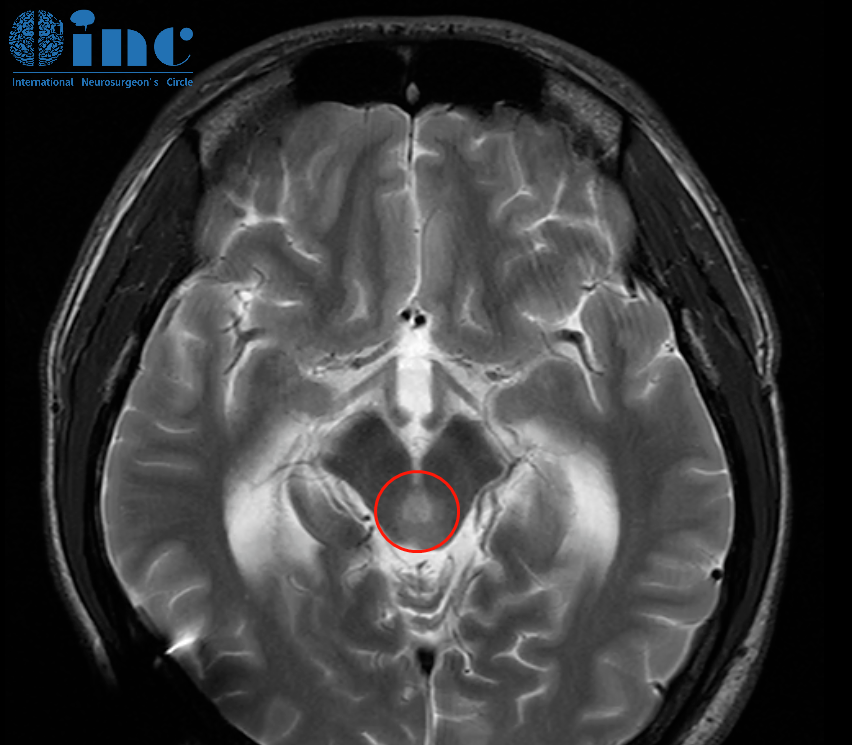
1CLC-3在胶质瘤增殖、迁移及凋亡中的作用
胶质瘤病理分级越高,肿瘤细胞的增殖、侵袭及迁移能力越强,肿瘤周围组织水肿也越明显。氯离子是细胞内、外液中较主要的阴离子,被认为是参与调节性细胞容积回缩(regulatory volume decrease,RVD)过程中的主要溶质。已经在许多细胞内都发现了细胞膨胀会使氯离子通道活化。
ClC-3作为电压依赖性氯离子通道家族中的重要成员之一,介导了细胞调节性容积变化,与细胞增殖、分化及凋亡等细胞周期事件有关。CLC-3在胃癌组织和细胞系中高表达,CLC-3的高表达与胃癌患者不良的临床病理参数和较短的总生存时间相关;通过体外沉默CLC-3可降低胃癌细胞的增殖、迁移和侵袭能力,而其过表达可促进胃癌细胞的增殖、迁移和侵袭能力。
在乳腺癌组织中ClC-3表达增加,通过沉默ClC-3可控制增殖细胞核抗原Ki-67、细胞周期蛋白D1和细胞周期蛋白E的表达;表明沉默ClC-3可控制细胞增殖和肿瘤生长。在鼻咽癌中二氢青蒿素的选择性抗肿瘤活性可能是通过特异性激活CLC-3,导致Cl-外排,诱导凋亡体积减少,进而导致Ca2+的积累和caspase-3的活化,较终诱导细胞凋亡;表明在二氢青蒿素的抗肿瘤活性中,CLC-3的激活起着至关重要的上游作用。细胞的增殖与细胞容积的变化密切相关。在中枢神经系统中,CLC-3在胶质瘤细胞容积调节过程中亦发挥重要作用。
Habela等研究发现,在胶质瘤细胞中敲除CLC-3不仅导致有丝分裂期Cl-电流降低,而且使有丝分裂前凝集(premitotic condenssation,PMC)过程变慢,阻止染色质凝集,从而影响细胞增殖。Hubbi等研究发现,在肿瘤的侵袭与迁移过程中,细胞形态的变化是促进细胞进行迁移的基本条件。CLC-3介导的Cl-及水的外流,以实现细胞体积改变和形态适宜,促进胶质瘤细胞侵入紧凑而曲折的细胞外间隙。同时,胶质瘤细胞的迁移与细胞内Ca2+浓度的变化也密切关系。
Montana等研究发现,缓激肽释放素通过缓激肽b2受体增加细胞内Ca2+浓度,并诱导细胞沿脑血管组织迁移。在表达ClC-3的胶质瘤细胞中,控制钙/钙调素依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)与直接控制ClC-3同样能减少胶质瘤的侵袭;而CaMKⅡ作为一个分子链将细胞内钙的变化,转化为细胞运动所需的ClC-3电导的变化;表明CLC-3可以被CaMKⅡ激活。然而,敲除CLC-3可以减少CaMKⅡ介导的Ca2+活化氯离子在胶质瘤细胞中的电流,并减少缓激肽释放素诱导的人胶质瘤细胞迁移。
2CLC-3在胶质瘤免疫逃逸中的作用
本课题组前期的研究发现,CLC-3在胶质瘤细胞中高表达,表达水平与肿瘤病理分级呈正相关、与预后呈负相关。CLC-3不仅介导Cl-外流,从而被动地调节细胞自身体积和形态来适应瘤周低渗水肿环境和受限的空间;还可以通过调节核因子-κB(nuclear factorκB,NF-κB)的活性来增加基质金属蛋白酶(matrix metalloproteinase,MMP)如MMP-3、MMP-9的表达,主动地调节肿瘤细胞外环境,促进胶质瘤细胞的侵袭和迁移。
陈列平教授团队研究认为,肿瘤微环境中肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)识别肿瘤相关抗原时,会释放炎症介质如γ-干扰素(Interferon-γ,IFN-γ)、脂多糖(Lipopolysaccharides,LPS)等;这些炎症介质可诱导肿瘤细胞表面PD-L1过表达,从而发挥负性免疫调节来逃避T细胞的杀伤。IFN-γ属于炎症介质,NF-κB是一个涉及到炎症和抗凋亡的关键转录因子,IFN-γ诱导PD-L1的表达依赖于NF-κB。在乳腺癌、肺癌及黑色素瘤等多项研究中均发现NF-κB可以调控PD-L1的表达。PD-L1作为肿瘤免疫逃逸中的重要分子,当肿瘤细胞PD-L1过表达,并与T细胞表面上的受体PD-1相作用,可负性调控免疫应答。
Wintterle等研究发现,12株胶质瘤细胞中均表达PD-L1mRNA和蛋白,在所研究胶质瘤组织标本中PD-L1表达均较强;但PD-L1在正常脑组织中表达却不明显。亦有研究表明胶质瘤组织高表达PD-L1,且与肿瘤病理分级和患者预后密切相关;PD-L1与PD-1结合可促进肿瘤内浸润的T淋巴细胞的凋亡。在内皮细胞中CLC-3介导的Cl-流出可降低细胞内Cl-浓度,从而促进NF-κB活化。
在P-糖蛋白依赖性人肺腺癌细胞系中,ClC-3表达上调可通过NF-κB信号通路诱导癌细胞产生多重耐药。这些研究结果均提示,CLC-3可能通过激活NF-κB信号通路在PD-L1介导的胶质瘤免疫逃逸中发挥重要作用。
- 文章标题:CLC-3在胶质瘤发生发展中的作用
- 更新时间:2021-11-09 14:48:01

 400-029-0925
400-029-0925