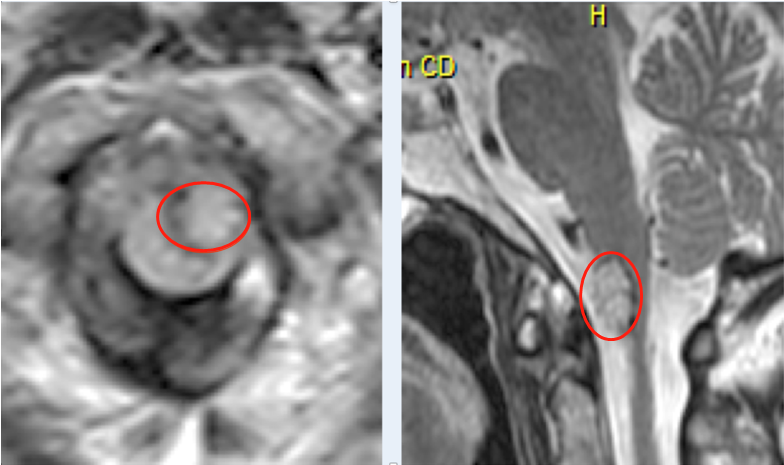
高级别胶质瘤(WHO III和IV级)在较初成功的手术和药物治疗后,几乎总是在几年内(III级)或几个月内(IV级)复发,导致患者死亡。这是由于这些肿瘤具有浸润性,几乎不可能进行完全切除,也由于存在某些细胞群,这些细胞在放疗和化疗中存活下来,导致肿瘤复发和进展。一种可能的方法是利用较近发现的正常干细胞向胶质瘤细胞迁移的特性,将治疗直接驱动到脑肿瘤的残余部位。
神经干细胞
观察到神经干细胞(neural stem cells, NSC)选择性地向脑肿瘤区域迁移并在那里逗留,这表明这些细胞可以作为药物和基因传递载体。为了开发一种靶向残余疾病的治疗策略,人类胶质母细胞瘤异种移植瘤接种了肿瘤坏死因子相关凋亡诱导配体(TRAIL)分泌NSC。凋亡细胞在肿瘤主体和其残余中均增加,肿瘤生长减少。神经干细胞被进一步开发,以产生抗肿瘤t细胞反应。将产生白细胞介素12 (IL-12)的神经干细胞接种于患有原位胶质瘤的C57Bl/6小鼠。与接种非分泌性神经干细胞或生理盐水的小鼠相比,这些小鼠的存活率增加。肿瘤微t细胞浸润增强,抗肿瘤免疫延长。Mercapide及其同事曾描述过通过神经干细胞将有毒基因传递到恶性胶质瘤。
间充质干细胞
间充质干细胞(MSC)向胶质瘤病变迁移,可以考虑作为基因传递载体来对抗人类恶性胶质瘤。骨髓间充质干细胞(hMSC)已被用作细胞载体,在胶质瘤肿瘤部位靶向传递和局部生产TRAIL。分泌TRAIL (S-TRAIL)和mCherry(红色荧光蛋白)通过慢病毒载体在hMSC中表达,通过体外和体内迁移实验确定,hMSC保持了向肿瘤区域迁移的能力。体外实验证实了STRAIL的表达、释放和生物活性。对免疫缺陷小鼠体内生长的原位肿瘤进行体内实验,注射产生S-TRAIL的基因工程hMSC可控制肿瘤生长并提高动物的存活率。与对照组相比,使用工程S-TRAIL hMSC的动物组肿瘤细胞凋亡增加了8倍。因此,hMSC可以作为治疗蛋白的载体进入肿瘤部位,特别是,表达strail的hMSC可能对胶质瘤有的治疗作用。
其他干细胞
标记有GFP (vMyxgfp)的野生型黏液瘤病毒可感染脂肪源干细胞(ADSC),该病毒可在脂肪源干细胞中合适复制,导致产生性感染。共培养实验表明,黏液瘤病毒感染的ADSC可交叉感染GBM细胞并选择性杀伤GBM细胞。在免疫缺陷小鼠的体内迁移实验中,vMyxgfp-ADSC在远离原位肿瘤的地方注射,显示黏液瘤病毒合适地传递到肿瘤细胞,从而提高了动物的生存。ADSC可被考虑用于递送溶瘤病毒,特别是黏液瘤病毒到脑瘤。造血祖细胞(HPC)可能是进一步的候选者,以细胞为基础的递送治疗胶质瘤。De Palma和同事利用促血管生成表达Tie2的单核细胞(TEM)的肿瘤趋向性,将ifn α特异性传递到肿瘤部位。利用免疫缺陷小鼠的原位胶质瘤模型系统,这些作者表明,转染Tie2启动子/增强子驱动的IFN-alpha基因的造血祖细胞可以减少肿瘤的生长和转移。tem介导的IFN-alpha传递后,肿瘤血管生成也被控制,而先天免疫和适应性免疫被激活。骨髓生成和伤口愈合未受损。因此,至少在这个实验系统中,通过透射电镜传递ifn - α可能有助于控制胶质瘤的生长。重要的是,将慢病毒转导的HPC注射到正常大脑中并不是致瘤的。同样,注射转基因HPC既不会改变动物的存活率,也不会减少放射治疗的疗效。因此,用慢病毒载体对HPC进行基因操作以递送治疗药物显然是一种顺利的程序。
基因治疗的临床意义
基因治疗可能是一种值得研究的方法来治疗某些形式的高级别神经胶质瘤。由于病毒载体对肿瘤的治疗性基因传递和表达效率低下,这一策略受到了阻碍。一种改进高级别胶质瘤基因治疗的可能方法是通过正常干细胞将病毒载体传递到肿瘤部位。使用这些载体细胞,工程治疗性病毒载体的递送和持久性都得到了好转,部分原因是来自不同组织的干细胞进入肿瘤部位的能力,部分原因是屏蔽了来自免疫系统的病毒颗粒。解决了一个问题,另一个很快就会出现:较近的证据表明,胶质瘤的进展可能与少见的细胞亚群(胶质瘤起始细胞(GIC))的存在有关,这些细胞在限制稀释试验中启动了肿瘤的发展,抗放射和化疗,经常(但不总是)表现出在适当条件下与神经元、少突胶质细胞或星形胶质细胞的分化能力。特异性靶向胶质瘤起始细胞可能是根治肿瘤的必要条件。不幸的是,正常的干细胞是否可以专门针对胶质瘤起始细胞仍然是一个开放性的问题。需要研究正常干细胞将毒性药物特异性递送给胶质瘤起始细胞。
相关参考资料来源:Doi:10.2174/138955711795906897
- 文章标题:胶质瘤患者必知的几种能够治疗高级别胶质瘤的干细胞
- 更新时间:2021-04-26 10:44:33

 400-029-0925
400-029-0925