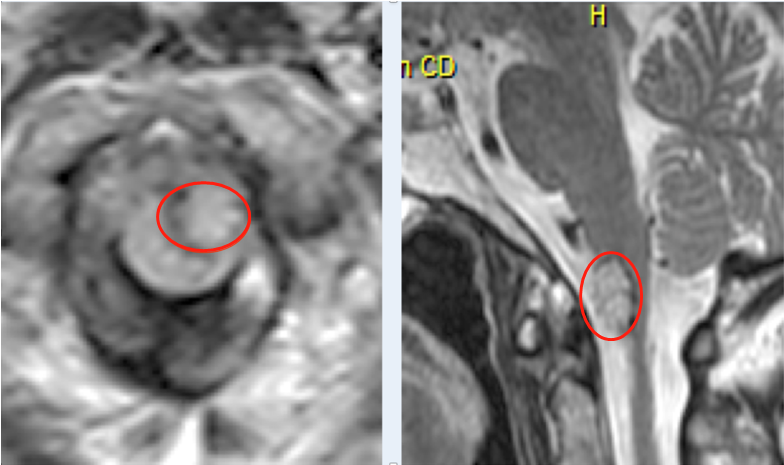
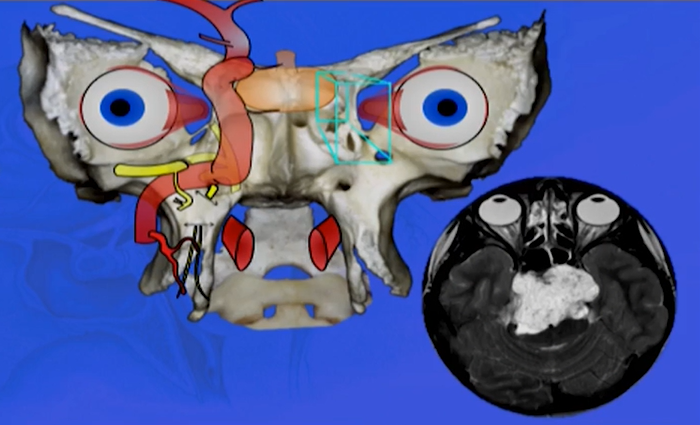
儿童脑瘤免疫治疗的临床新进展,过去的40年,儿童肿瘤的治疗取得了令人瞩目的成绩。但是,每年的死亡病例仍不在少数,肿瘤复发和治疗相关的并发症是主要原因。因此,对于难治和复发的恶性肿瘤,开展免疫治疗不失为一挽救性策略。近年来肿瘤免疫治疗领域进展迅速,出现了许多新技术、新方法,临床试验正在开展,使之成为颇具前景的治疗儿童肿瘤的选择。
一、基于单克隆抗体的靶向治疗
单克隆抗体通过识别肿瘤细胞表面的特异性肿瘤抗原,发挥抗体依赖的细胞介导的细胞毒作用和补体依赖的细胞毒作用而增强机体的抗肿瘤能力。针对CD20的利妥昔单抗在治疗儿童恶性淋巴瘤的临床应用中取得了很好的疗效。
通过CD20单抗和化疗的联合应用,儿童Ⅲ/Ⅳ期非霍奇金淋巴瘤( NHL)的3年无事件生存率(EFS)可达到95%,显示出此类药物的良好临床应用前景。目前针对儿童淋巴系统恶性肿瘤正在研发或处于临床试验阶段的单克隆抗体包括抗CD19、抗CD22、抗CD25、抗CD30、抗CD33、抗CD45、抗CD52单抗以及抗CD3/CD19双抗等。
CD19是治疗B系肿瘤的重要靶点。ALL患儿造血干细胞移植前后输注CD19单抗可明显降低肿瘤负荷,反应率在50%以上,且患儿耐受性良好。抗CD3/CD19双抗blinatumomab是将抗CD3和抗CD19的单链抗体偶联,从而使细胞毒性T淋巴细胞( CTL)和CD19+的靶细胞通过该介质迅速连接到一起,让CTL发挥杀伤作用。
成人NHL和ALL患者对blinatumomab具有良好的反应性,可以达到75%以上的疾病缓解率。儿童方面,有病例报道blinatumomab的治疗可以使ALL移植后的复发病例获得完全缓解。而一项大规模的多中心研究表明,骨髓复发的ALL患儿通过1-5个疗程blinatumomab的治疗,47%的骨髓复发病例可以达到骨髓细胞学和分子生物学缓解。
抗CD22单抗有望成为靶向治疗B系肿瘤的另一新药,一代抗CD22免疫毒素BL22(CD22单抗与假单胞菌外毒素A偶联)在治疗儿童ALL和NHL方面耐受性良好,但患儿有短期的治疗反应,总体效果并不理想。2代高亲和力CD22单抗免疫毒素治疗难治复发性的CD22+ALL和NHL的I期临床试验正在开展,中期结果表明其反应率达到61%,其中17%的患者可以达到完全缓解。
CD30单抗药物偶联体brentuximab vedotin治疗难治复发霍奇金淋巴瘤及间变大细胞淋巴瘤可以达到75% - 85%的反应率和34%的完全缓解率,但存在外周神经病变等副作用,因此,2012年,美国、德国等6个国家联合开展了一项性的利用brentuximab vedotin治疗儿童霍奇金淋巴瘤及间变大细胞淋巴瘤的Ⅰ/Ⅱ期临床试验,目前该临床试验仍在进行中。
在实体肿瘤方面,利用抗双唾液酸神经节苷脂GD2抗体治疗小儿神经母细胞瘤(NB)的研究相对较为成熟。人鼠嵌合抗CD2单抗ch14. 18在早期的临床研究中即表现出的抗NB作用。联合粒细胞一巨噬细胞集落刺激因子和白介素2(IL-2)后,抗体依赖的细胞介导的细胞毒作用增强,但无明显不良反应。
近期,美国儿童肿瘤协作组比较了高危NB患者在自体干细胞移植后采用ch14. 18联合粒细胞一巨噬细胞集落刺激因子、IL-2和13顺式维甲酸的四联维持治疗和单用13顺式维甲酸维持治疗的疗效。这一Ⅲ期临床试验结果表明,免疫治疗组的2年EFS较单用13顺式维甲酸组提高了20%,1岁以上的Ⅳ期NB的2年EFS亦从42%提高到63%。
美国戴纳.法柏( Dana-Farber)癌症研究中心将GD2单抗与IL-2偶联治疗复发NB,但患儿治疗反应差别大,毒副反应较大,患者可出现休克、呼吸衰竭等严重并发症。亦有研究采用偶联GD2抗体制成放射性单抗,然后通过鞘内给药的方式来治疗中枢神经系统(CNS)复发的NB病例,21例患者中,17例CNS的肿瘤细胞被清除,已经在CNS复发后存活7-74个月。
二、过继性T细胞免疫治疗
目前,已经应用于临床的过继性T细胞免疫治疗手段主要包括:(1)肿瘤浸润淋巴细胞输注治疗黑色素瘤和卵巢癌;(2)EB病毒特异性的T细胞输注治疗EB病毒相关的肿瘤;(3)基因修饰的T细胞输注治疗血液系统肿瘤和实体肿瘤。其中后两项在儿科肿瘤领域均有应用。
造血干细胞移植后的长期免疫控制治疗导致患儿罹患淋巴增殖性疾病的风险明显增加,而该病在很大水平上与EB病毒的感染或活动有关。因此,美国纪念斯隆凯待琳( Memorial Sloan-Kettering)癌症中心的学者采用EB病毒特异性的供者T细胞输注到干细胞移植后继发淋巴增殖性疾病的受者体内,70%左右的病例可以获得缓解,显示了该治疗策略的合适性。
美国贝勒医学院的细胞治疗中心等单位开始进行移植后患儿输注EB病毒特异性CTL预防淋巴增殖性疾病的临床试验,观察17年来,实验组101例患儿无一发生淋巴增殖性疾病(对照组发生率为11%),该项治疗顺利合适。T细胞基因修饰主要包括嵌合抗原受体(CAR)技术和T细胞受体(TCR)转移技术。将CAR修饰的T细胞回输进行肿瘤治疗是目前免疫治疗领域发展较快的方向。
通过基因工程技术将识别某抗原分子的抗体可变区基因序列与淋巴细胞免疫受体的胞内区序列拼接后,通过逆转录病毒或慢病毒载体、转座子或转座酶系统或直接将mRNA转导到淋巴细胞内,并表达融合蛋白于细胞表面。
使淋巴细胞能通过非主要组织相容性复合物(MHC)限制性的方式识别特定抗原,增强其识别和杀伤肿瘤的能力,将该基因修饰的T细胞在体外扩增后回输到肿瘤患者体内可以发挥抗肿瘤作用。相比于传统的T细胞,CAR修饰的T细胞既超越了抗原识别过程中的MHC依赖性,同时也可以通过改造信号域中的共刺激分子来达到增强功能的目的,具有强大的优势。
CD19是免疫治疗的重要靶标,目前正在开展的基于靶向CD19的CAR-T细胞的临床试验有数十项之多。它在成人慢性淋巴细胞白血病的治疗中取得了明显的疗效,采用CD19单抗、4-1BB和TCR/CD3的ζ链构建CAR-T细胞能在体内扩增1000倍以上,存在超过6个月,能合适杀伤肿瘤细胞,使患者获得长期完全缓解。
部分对化疗不敏感的患儿在CAR-T细胞输注后可以获得缓解,清除肿瘤后尽早进行移植,可以使患儿获得良好的结局。目前尚未有基于抗CD20单抗的CAR-T细胞治疗儿童肿瘤的报道,但从成人小规模的临床试验来看,虽然1代抗CD20单抗的CAR临床效果有限(可评估病例多为部分缓解或带瘤牛存),但3代CD20CAR的效果明显提高。
亦有学者采用抗CD30单抗和CD28信号域构建2代CAR治疗霍奇金淋巴瘤,但该CAR-T细胞在体内存活时间短,因此临床疗效不理想,他们也正试图通过将信号分子改为4-1BB、增加趋化因子受体CCR4等手段来优化CAR的结构以增强功能。
在急性髓系白血病(AML)方面,意大利科学家成功构建了分别针对CD33和CD123的3代CAR(anti-CD33-CD28-OX40-ζ和anti-CD123-CD28-OX40-ζ)并转导到细胞因子诱导的NK细胞中,该CAR修饰的NK细胞在动物模型中表现出很强的清除肿瘤细胞的能力,但尚未有临床应用的报道。
实体肿瘤方面,同样以GD2单抗的研究较为深入。得克萨斯儿童医院采用抗GD2单抗构建1代CAR治疗复发的Ⅲ/Ⅳ期NB患儿。11例病例中有3例获得完全缓解,至随访截止,较长的持续缓解已近5年。也有学者试图采用抗GD2抗体构建CAR来对T细胞及NK细胞进行基因修饰以治疗尤文肉瘤,体外实验和动物模型均显示出良好的抗肿瘤能力。
目前采用人类表皮生长因子受体HER2单抗构建CAR-T细胞治疗HER2+的儿童恶性肿瘤(如骨肉瘤、胶质母细胞瘤等)的临床试验正在进行中,未发现明显不良反应。除了采用CAR技术对T细胞的基因修饰,TCR的转移也是常用的方法。将某一抗原特异性的TCR基因转移到T细胞内,可以使T细胞获得识别某一特定抗原的能力,而发挥对表达该抗原靶细胞的杀伤作用。
该技术在转移性黑色素瘤患儿的治疗中的应用获得了成功。儿童肿瘤方面,由于转录因子Wilms肿瘤基因WTI在儿童白血病及实体肿瘤中高表达,有学者将WTI特异性TCR转导到T细胞中来过继治疗相关肿瘤,并在白血病动物模型中取得了成功。
三、NK细胞输注免疫治疗
NK细胞是介导机体固有免疫的淋巴细胞,由于其杀伤作用不依赖于肿瘤相关抗原的识别,因此NK细胞的过继免疫治疗一直备受关注。通过将NK细胞与人工的抗原递呈细胞在含IL-15、IL-21等细胞因子的条件下共同孵育可以得到成百上千倍的扩增,以供临床应用。
NK细胞输注多作为肿瘤治疗的辅助手段,如白血病和实体肿瘤患者在造血干细胞移植后接受供者来源的NK细胞输注。在一项5例AML患者(3例儿童)的研究中,患者在半相合造血干细胞移植后3-12个月接受供者NK细胞输注以治疗植入不良及早期复发。
输注后无一例发生移植物抗宿主病,2例患者的供者成分植入明显增加。另一项相似的研究中,3例多次复发的AML患者在造血干细胞移植后接受NK细胞输注,输注后均达到完全缓解,且骨髓完全为供者表型。此外,NK细胞输注甚至可以作为一次缓解后的高危白血病患者接受同胞供者干细胞移植的替代治疗。
美国圣吉德( St.Jude)儿童研究医院2010年报道了NK AML的临床研究,10例AML患儿在经过低剂量环磷酰胺及氟达拉滨预处理后接受了KIR不合的NK细胞输注及6次低剂量的IL-2注射。治疗后全部病例均能在体内检测到NK细胞的明显扩增,未出现血液学毒性及移植物抗宿主病,中位随访时间946 d,全部患儿均处于完全缓解状态,2年EFS达到全切。
目前发现,NK细胞的细胞毒作用与KIR的表型有关。KIR限制了NK细胞对表达自身MHC I类抗原的肿瘤细胞的杀伤,因此,采用KIR不相匹配的供者NK细胞输注是目前常用的做法。
美国儿童肿瘤协作组目前正在开展临床试验观察KIR匹配程度与高危AML患儿无关全相合造血干细胞移植的疗效关系;此外,圣吉德儿童研究医院采用CD19单抗修饰的NK细胞输注治疗儿童ALL,目前临床试验正在开展之中。
四、肿瘤疫苗的临床应用
树突状细胞(DC)在启动和调节肿瘤特异性的免疫应答过程中发挥着关键作用。随着对DC活化肿瘤反应性T细胞、B细胞及NK细胞认识的不断深入,基于DC的肿瘤免疫治疗的理念也应运而生。1996年,美国斯坦福大学一次报道了采用自体DC治疗B细胞淋巴瘤的临床试验,3例患儿中2例完全缓解,1例部分缓解,取得了良好的疗效。
目前制作DC疫苗的主要策略是分离患者外周血中的单核细胞或CD34+干/祖细胞,然后在特定的细胞因子混合培养基中进行培养扩增,在DC成熟的过程中通过添加特定的抗原肽、细胞裂解物或肿瘤细胞进行刺激,使之成为具有递呈特定肿瘤抗原能力的成熟DC,然后回输至患儿体内进行治疗。
有学者采用神经胶质瘤细胞裂解物负载DC,体外扩增后进行输注治疗儿童晚期神经胶质瘤病例。3例患儿中2例无瘤存活,且无严重不良反应。
也有学者将负载WT1抗原肽的DC细胞在体外反复刺激T细胞,以获得大量WT1特异性的CTL,然后将CTL回输至患儿体内治疗造血干细胞移植后白血病复发患者,但因该CTL在体内存活时间短(仅1-2周),因此疗效并不理想。为了克服多肽制备上的困难,有学者直接将WT1全长mRNA通过电穿孔方式注入到DC内,然后回输治疗AML患者,可以使患儿获得完全缓解。
儿童肿瘤的治疗虽然取得了较大进步,但部分难治复发的肿瘤目前仍难以攻克,是转移性肉瘤、脑瘤等实体肿瘤目前的治疗进展还不多。免疫治疗虽然有广阔的临床应用前景,但也面临着不少问题。CAR治疗技术目前仍处于起步阶段,其结构优化、疗效提升还需要进一步研究。
总而言之,免疫治疗提出了肿瘤治疗的崭新的理念与方法,建立除放疗、化疗、造血干细胞治疗外新的治疗手段,但更大的进步有赖于科研成果和临床试验之间的快速转化和反馈,有赖于广大肿瘤工作者的不懈努力。
- 文章标题:儿童脑瘤免疫治疗的临床新进展
- 更新时间:2021-12-22 14:50:01

 400-029-0925
400-029-0925