引文:
脑胶质瘤分为4级,一、二级为低级别脑胶质瘤,三、四级为高级别脑胶质瘤,其中高级别胶质母细胞瘤(四级)占比超过50%,恶性程度较高,预后效果较差。目前对于胶质瘤的治疗,包括手术、放疗、化疗、靶向治疗等手段。 具体的治疗,要综合考虑患者的功能状态、对治疗的预期结果以及肿瘤所处的脑区部位、恶性程度级别等多种因素,进行综合考虑判断,从而制定个体化综合治疗方案,本文引您细读较新指南是怎么说高级别脑胶质瘤的治疗。
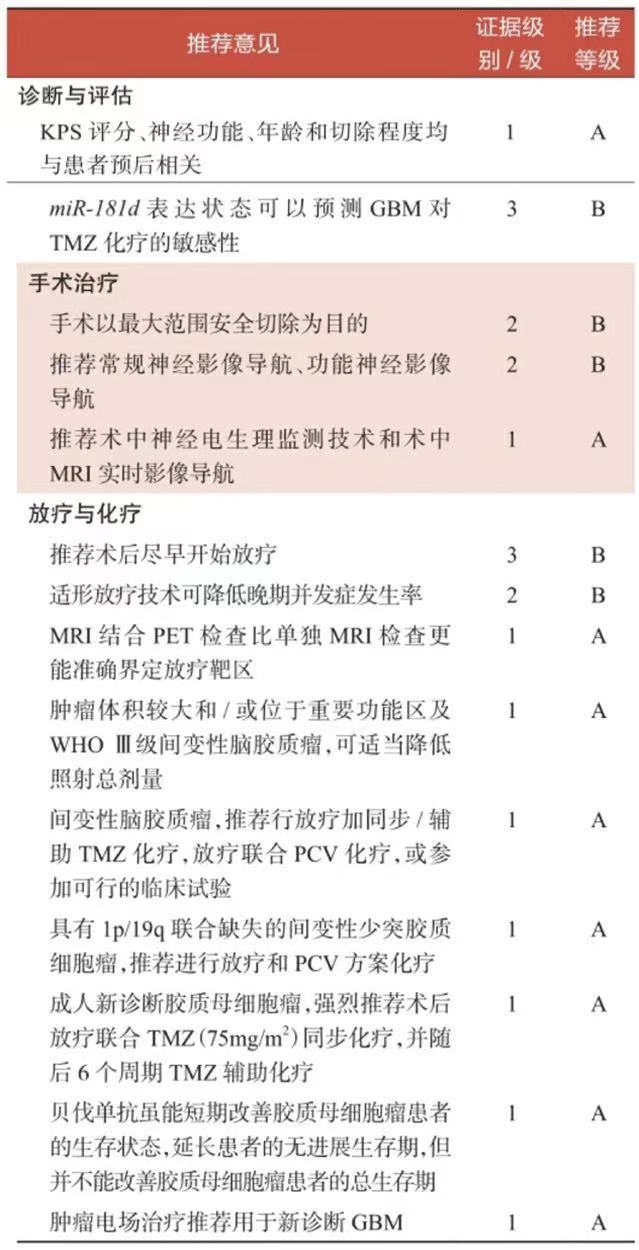
一、指南意见汇总总结
高级别脑胶质瘤指WHO Ⅲ级和Ⅳ级的胶质瘤。Ⅲ级胶质瘤主要包括间变性星形细胞瘤和间变性少突胶质细胞瘤,Ⅳ级胶质瘤包括胶质母 细胞瘤(glioblastoma multiform,GBM)和弥漫性中线胶质瘤,H3K27M突变型。室管膜瘤和弥漫性中线胶质瘤将在后续单独章节中更新。
此次指南意见汇总如下:
二、诊断与评估
(一)高级别脑胶质瘤的分子病理分型
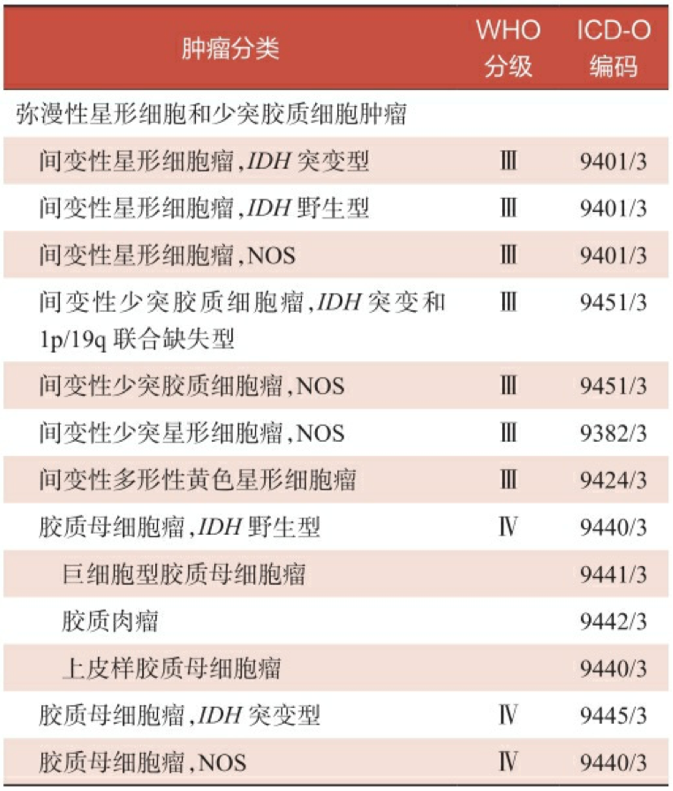
根据2016版WHO中枢神经系统肿瘤分类标准,高级别脑胶质瘤的整合病理诊断主要包括传统组织病理学分类和分子表型,详见表3-1。
1.高级别胶质瘤组织病理学分类
WHO Ⅲ级胶质瘤表现为细胞密度增高,核异型性明显,核分裂象 增多,Ki-67/MIB-1增殖指数5%~10%;
WHO Ⅳ级胶质瘤可见细胞密度增高,明显的核异型、活跃的核分裂活性、明显的微血管增生和/或坏死,Ki-67/MIB-1增殖指数>10%。
值得注意的是,Ki-67/MIB-1增殖指数只作为肿瘤分级的参考,目前尚无准确的阈值可以用来明确区分肿瘤级别。
表3-1 2016版WHO中枢神经系统肿瘤分类标准——高级别脑胶质瘤的种类
注:NOS,非特指。
2.分子表型
间变性星形细胞瘤(WHO Ⅲ级)
指具备间变性特征的星形细胞瘤,增生活跃,存在区域性或弥漫性细胞密度增高,可见大量核分裂 象,核异型性更为明显,但无微血管增生和/或坏死。
IDH突变型间变性星形细胞瘤
较常见,约占80%,伴IDH1或IDH2基因突变,这类肿瘤可进展为IDH突变型GBM。IDH野生型间变性星形细胞瘤无IDH基因突 变,较少见,占20%,这类肿瘤恶性程度高于IDH突变型间变性星形细 胞瘤,与IDH野生型GBM相似。
间变性少突胶质细胞瘤(WHO Ⅲ级)
指具备间变性特征的少突胶 质细胞瘤,包括细胞密度高、细胞异型性明显、核分裂象增多、微血管 增生和/或坏死,并以IDH基因突变和1p/19q联合缺失为重要分子特征。
IDH野生型GBM(WHO Ⅳ级)
是恶性程度较高的星形细胞肿瘤, 由分化差的肿瘤性星形细胞组成,细胞密度高、核异型性明显、核分裂象多见,并见大量病理性核分裂象、明显的微血管增生和/或坏死是诊断的基本要点。IDH野生型GBM无IDH基因突变,占全部GBM的90%。 主要见于成人,男性多发,多为原发性,位于幕上,可累及周围及远处 脑组织。除IDH1、IDH2基因突变以外,检测的分子指标还包括 MGMT启动子区甲基化、EGFR vⅢ重排、TERT启动子区突变(C228T 和C250T)等。检测7号/10号染色体相关基因(MET、PTEN等)及融合 基因(FGFR1-TACC1、FGFR3-TACC3)有助于患者预后的评估及靶向药物的选择。另外,miR-181d对于GBM是一个预后相关的可靠指标,其表达状态可以评估患者对TMZ化疗的敏感性。
巨细胞型GBM、胶质肉瘤及上皮样GBM均是IDH野生型GBM的不同亚型。巨细胞型GBM较为少见,主要由含怪异形核的细胞及多核巨 细胞组成,偶可见丰富的网状纤维。AURKB表达及TP53突变常见,EGFR基因扩增少见,此亚型患者预后优于其他类型GBM。胶质肉 瘤具有胶质和间叶组织双向分化的特点,常与GBM有关,也可由室管 膜瘤和少突胶质细胞瘤转化而来。主要见于成人,可原发或继发,预后 较差。上皮样GBM含有密集排列的上皮样细胞、部分横纹肌样细胞、 核分裂活跃、微血管增生和/或坏死,BRAF V600E突变率较高 (50%~60%)。好发于小儿及青年人,常见于大脑和间脑,预后差。
IDH突变型GBM(WHO Ⅳ级)伴有IDH1或IDH2基因突变,占全部GBM的10%,往往由弥漫性星形细胞瘤或间变性星形细胞瘤发展而来。检测7号染色体/10号染色体相关基因(EGFR、MET和PTEN等)及 融合基因(PTPRZ1-MET)有助于患者预后的评估及靶向药物的选择。
(二)高级别脑胶质瘤的影像学评估
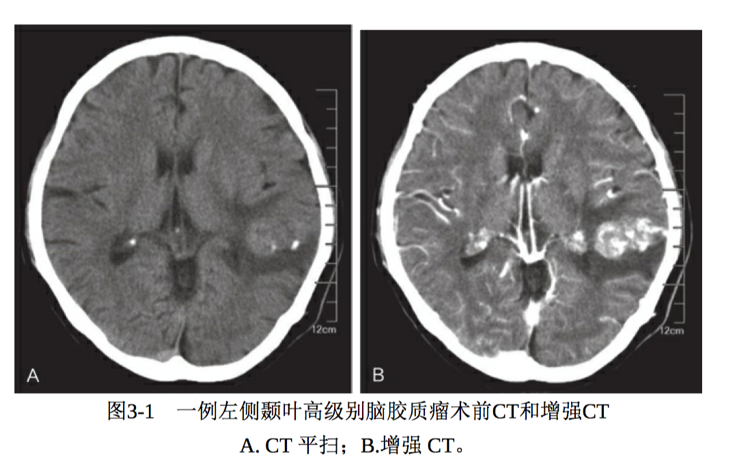
1.CT
高级别脑胶质瘤CT表现为密度不均,以低密度和等密度的混杂密度为多。低密度为肿瘤的坏死或囊变区域。增强表现为明显强化,呈现不规则的环状强化,强化的瘤壁上可见瘤结节。肿瘤可沿着胼胝体向对侧侵袭,强化表现为蝴蝶状,呈现明显的占位效应,肿瘤周围水肿明显 (图3-1)。
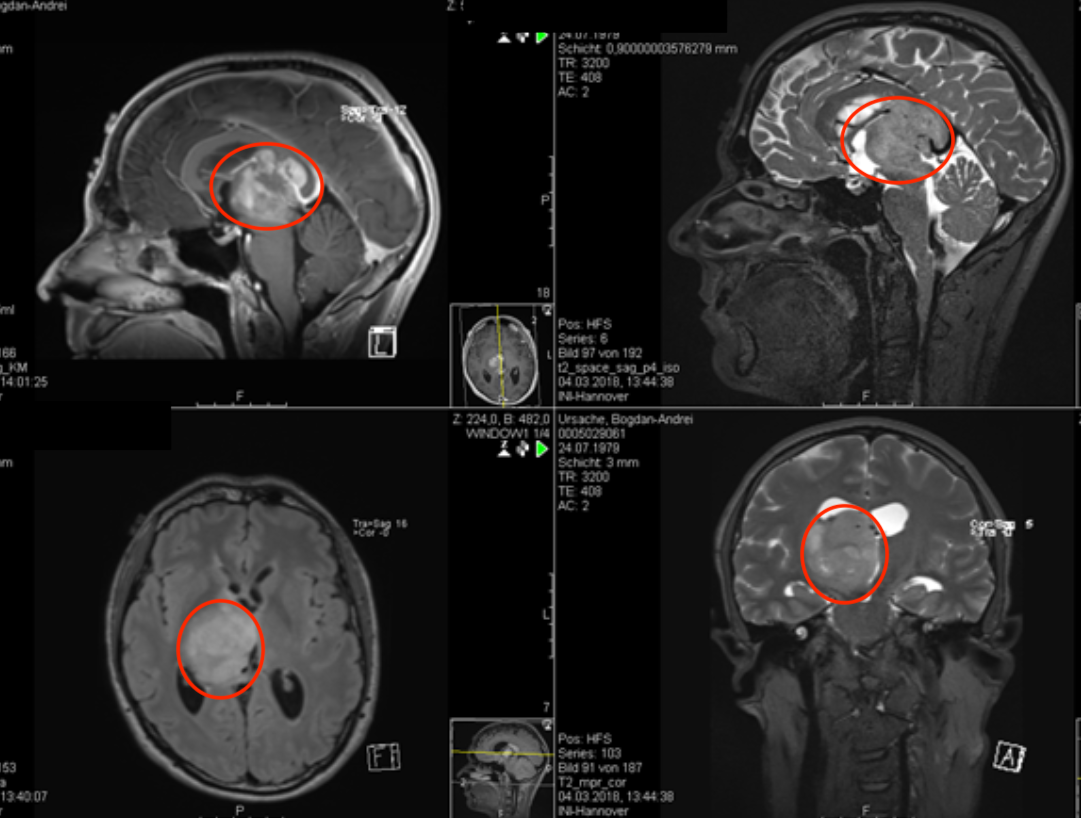
2.MRI
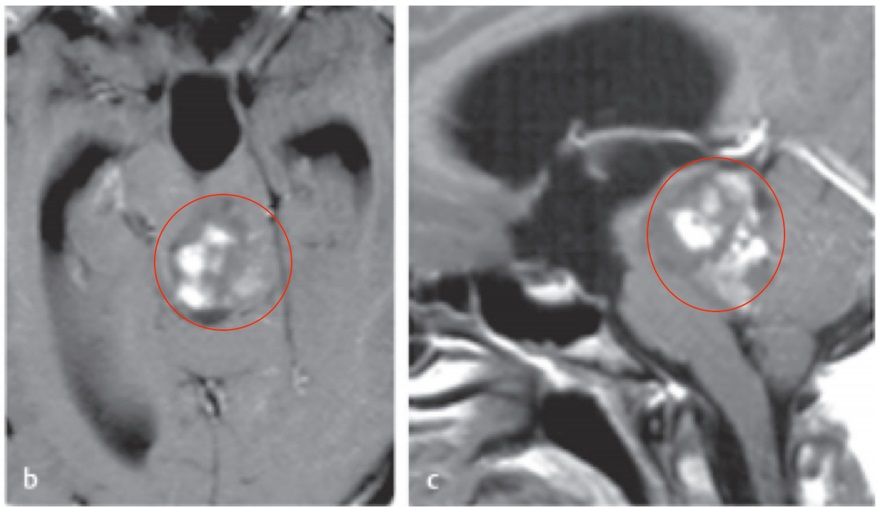
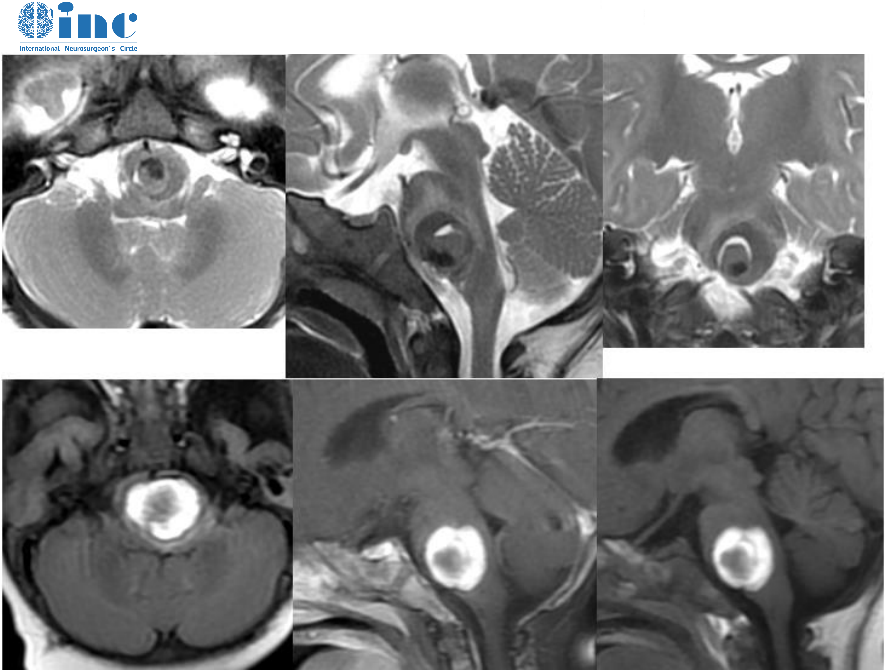
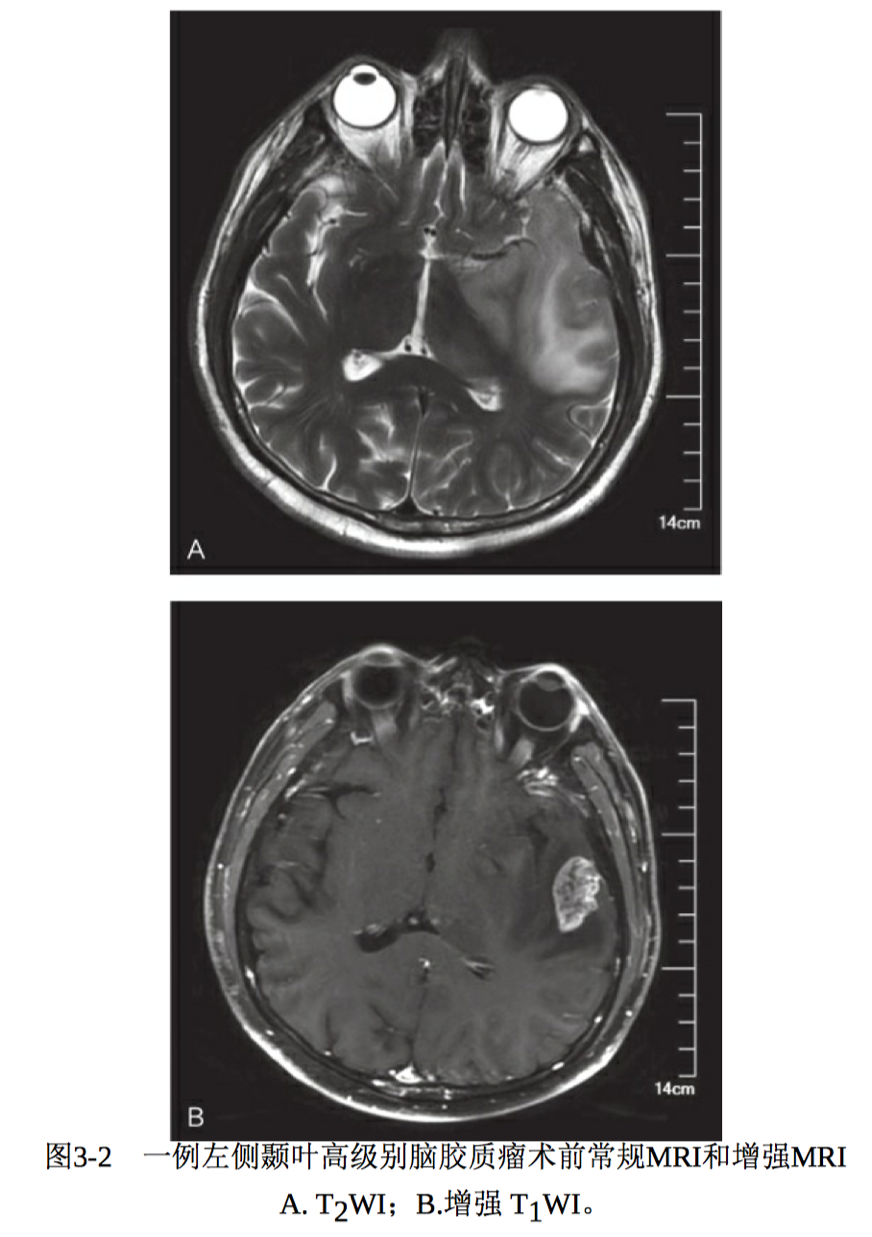
高级别脑胶质瘤的MRI信号明显不均匀,呈混杂T1 /T2 信号影,周边明显指状水肿影;占位征象明显,邻近脑室受压变形,中线结构移位, 脑沟、脑池受压;肿瘤常沿着白质纤维播散。增强扫描呈明显花环状及结节样异常强化影,常有强化伴卒中、坏死及囊变(图3-2)。
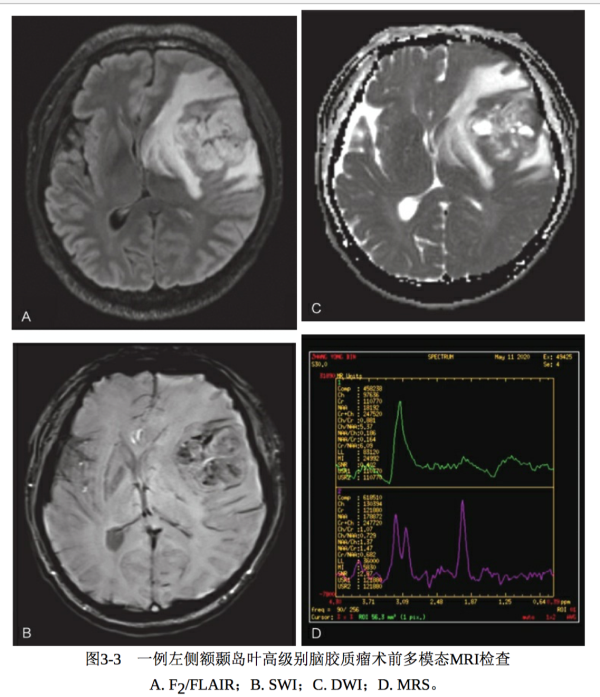
多模态MRI检查可提供肿瘤的血流动力学、代谢、神经纤维组织受累状况和皮质功能区等信息,对于脑胶质瘤的鉴别诊断、确定手术边界、预后判断、监测治疗效果及明确有没有复发等具有重要意义,是形态成像诊断的一个重要补充。多模态MRI检查序列包括DWI、PWI及MRS 等。DWI高信号区域提示细胞密度大,代表高级别病变区;PWI高灌注区域提示血容量增多,多为高级别病变区;MRS中Cho峰和Cho/NAA升 高,与肿瘤级别呈正相关,NAA峰降低,出现Lip和/或 Lac峰(图 33)。
3.PET
不同级别脑胶质瘤的PET成像特征各异,目前广泛使用的示踪剂为18 F-氟代脱氧葡萄糖(18 F-FDG),高级别脑胶质瘤代谢活性可接近或高于正常脑灰质。脑胶质瘤代谢成像的肿瘤-本底对比度偏低,而氨基酸肿瘤显像具有较好的组织对比度,因此建议采用氨基酸PET脑显像来评估脑胶质瘤的恶性度级别。11 C-蛋氨酸(11 C-MET) -PET评估准确 性高于MRI,高级别脑胶质瘤的11 C-MET代谢活性通常高于低级别脑胶质瘤,但高/低级别脑胶质瘤间仍存在的重叠。必要时建议使用18 FFET-PET动态成像分析以提高对脑胶质瘤的影像学分级。另外,PET联 合MRI检查比单独MRI检查更有助于准确界定放疗靶区。
患者有颅内压增高或相应的神经定位症状,影像学提示高级别脑胶质瘤时诊断不难。当MRI/CT表现似星形细胞瘤或少突胶质细胞瘤伴强化时,提示间变性脑胶质瘤的可能性大。而GBM的影像学特征为不规 则形周边强化和中央大量坏死,强化外可见水肿。
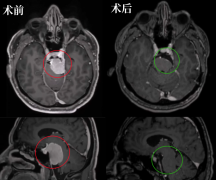
高级别脑胶质瘤治疗后的影像学评估:脑胶质瘤术后24~72h内需复 查MRI(平扫+增强),评估肿瘤切除程度,并以此作为脑胶质瘤术后 基线影像学资料,用于后续比对。脑胶质瘤治疗效果的影像学评估参见 RANO标准。
三、手术治疗
高级别脑胶质瘤强烈较大范围顺利切除。手术目的包括:缓解由高颅压和压迫引起的症状;降低类固醇药物使用,维持较好的生存状 态;降低肿瘤细胞负荷,为辅助放化疗创造条件;延长生存期;获得精 确病理诊断。
与单纯活检相比,尽可能切除肿瘤是影响高级别脑胶质瘤患者预后的重要因素,但由于高级别脑胶质瘤的浸润特性,实现病理上完全切除 肿瘤常较困难。新型手术辅助技术的运用有助于实现高级别脑胶质瘤的较大范围顺利切除。肿瘤切除程度是高级别脑胶质瘤的独自预后因素之 一,肿瘤全切除可延长术后肿瘤复发时间和患者生存期。
应用的手术辅助技术包括常规神经影像导航、功能神经影像导 航、术中神经电生理监测技术(例如皮质功能定位和皮质下神经传导束 定位)和术中MRI实时影像神经导航。多模态神经导航联合术中皮质及 皮质下定位,可进一步提高手术顺利性,保护神经功能,有利于较大范 围顺利切除。可应用的手术辅助技术还包括荧光引导的显微手术和 术中超声实时影像定位。
四、放射治疗
手术是高级别脑胶质瘤的基础治疗,术后放疗等是不可或缺的重要 治疗手段,高级别脑胶质瘤患者接受术后放疗可以取得的生存获 益。
(一)放疗时机
高级别脑胶质瘤患者的生存期与放疗开始时间密切相关,术后早期放疗能合适延长患者生存期,强烈术后尽早开始放疗。
(二)放疗技术
采用三维适形(3D-CRT)或适形调强技术(IMRT),常规分次,适形放疗技术可提高靶区剂量的覆盖率、适形度及对正常组织的保 护,缩小不必要的照射体积,降低晚期并发症的发生率。放疗前图像验 证(CBCT或EPID)是放疗质控不可缺少的环节。
(三)放疗剂量
放疗照射总剂量为54.0~60.0Gy,1.8~2.0Gy/次,分割30~33 次,每日一次,肿瘤体大和/或位于重要功能区及WHO Ⅲ级间变性 脑胶质瘤,可适当降低照射总剂量。尽管3D-CRT或IMRT能提高靶区适 形度、减少正常组织受量,较大限度地缩小照射体积,能够给予靶区更 高的放疗剂量,但提高剂量后的疗效尚未得到证实,不可盲目提高照射 总剂量或提高分次剂量。
(四)放疗靶区确定
高级别脑胶质瘤的放疗靶区争议至今,其焦点主要是较初的CTV是 否需要包括瘤周的水肿区,美国RTOGCTV1需包括瘤周水肿区外2.0cm区域,给予46.0Gy,缩野后CTV2需在GTV外扩2.0cm,剂量增至60.0Gy。2018年NCCN指南MRI T1 增强或T2 /FLAIR异常信号为 GTV,外扩1.0~2.0cm形成WHOⅢ级胶质瘤的CTV,而外扩2.0~2.5cm形 成GBM的CTV。CTV外扩3~5mm形成PTV;而T2 /FLAIR显示的水肿区 建议包括在一程的CTV1中(46.0Gy/23f),二程增量区(14.0Gy/7f)应 仅仅包括残余肿瘤或术后瘤腔外扩2.0cm形成的CTV2。Ⅱ期临床试验证实包括或不包括水肿区在肿瘤控制和生存期上无明显差异,欧洲癌症研究和治疗组织(European Organisation for Research and Treatment of Cancer,EORTC)的CTV设定并不强调要包括全部瘤周水肿区。
靶区勾画原则是在顺利的前提下,尽可能确定肿瘤达到60.0Gy的照射剂量,应参考术前与术后MRI,正确区分术后肿瘤残存与术后改变。 在临床实践中,医师应根据靶区位置、体积、患者年龄及KPS评分等因素综合考虑,灵活运用以上关于靶区设定的建议,平衡照射剂量、体积与放射性损伤之间的关系。
五、化学治疗
对于高级别脑胶质瘤,由于其生长及复发迅速,进行合适的个 体化化疗会更有价值。
(一)经典化疗方案
1.Stupp方案
在放疗期间口服TMZ 75mg/(m2 ·d),连服 42d;间隔 4 周,进入 辅助化疗阶段,口服TMZ 150~200mg/(m2 ·d),连用 5d,每 28d 重 复,共用 6个周期。
2.PCV方案
甲基苄肼(PCB)60mg/(m2 ·d),d8~21;洛莫司汀(CCNU) 110mg/(m2 ·d),d1;长春新碱(VCR) 1.4mg/m2 ,d8、d29。8 周为 一周期。
可以选择的其他化疗药物还有卡莫司汀、伊立替康、依托泊苷、顺 铂、卡铂、环磷酰胺等。
(二)间变性脑胶质瘤的化疗
对于间变性星形细胞瘤,进行放疗加TMZ辅助化疗,放疗同步加辅助TMZ化疗,放疗联合PCV化疗,或者参加可行的临床试验。
对于具有1p/19q联合缺失的间变性少突胶质细胞瘤,进行放疗和PCV方案化疗,放疗加同步或者辅助TMZ辅助化疗,或者接受可行的临床试验。
对于KPS评分<60的间变性脑胶质瘤,进行放疗(短程放疗和常规分次放疗),MGMT启动子区甲基化者,建议接受TMZ治疗,也可以采用姑息治疗。
(三)GBM的化疗(年龄≤70岁)
对于KPS评分≥60的患者,若存在MGMT启动子区甲基化,进行常规放疗加同步和辅助TMZ化疗,常规放疗加同步和辅助TMZ化疗 加电场治疗,或接受可行的临床试验。对于MGMT启动子区非甲基化和 甲基化情况不明确者,进行放疗同步并辅助TMZ化疗,常规放疗加 同步和辅助TMZ化疗加电场治疗,单纯标准放疗,或接受可行的临床试 验。
对于KPS评分<60的患者,在短程放疗的基础上,加或者不加同步和辅助TMZ化疗;存在MGMT启动子区甲基化的患者,也可单独采用TMZ化疗,或姑息治疗。
六、联合放化疗
(一)胶质母细胞瘤
强烈成人新诊断者术后放疗联合TMZ(75mg/m2 )同步化疗, 并随后6个周期TMZ辅助化疗。在放疗中和放疗后应用TMZ化疗,可以延长患者生存期,这一协同作用在MGMT启动子区甲基化患者中更 为明显。
(二)间变性脑胶质瘤
对于存在1p/19q联合缺失的间变性脑胶质瘤患者,化疗和放疗更为 敏感,放疗联合PCV化疗作为一线治疗方案,目前TMZ对WHO Ⅲ 级肿瘤的治疗初步显示疗效,而且不良反应更少。研究TMZ、放疗、 1p/19q联合缺失三者关系的两项大型随机临床试验正在进行中,中期研究结果显示,对于无1p/19q联合缺失者,放疗联合12个周期TMZ化疗, 可以好转患者生存期。IDH和TERT启动子区突变状态与间变性脑胶 质瘤患者的预后密切相关,IDH野生型伴或不伴TERT启动子区突变者, 临床预后较差,应提高放化疗强度,在WHO Ⅱ级脑胶质瘤中也同样存在这样的现象。
间变性脑胶质瘤的放化疗策略应根据患者具体情况,包括一般状 态、分子生物学标记和治疗需求等采用个体化治疗策略,治疗选择包括 术后单纯放疗、放疗结合TMZ同步和/或辅助化疗等。
其他药物治疗方式还包括分子靶向治疗、生物免疫治疗等,目前均尚在临床试验阶段,应当鼓励有条件及符合条件的患者在不同疾病阶段 参加药物临床试验。
七、靶向治疗
靶向治疗是在分子水平上,应用针对明确的生物标志物设计的药 物,瞄准和杀伤肿瘤细胞,这种治疗方式是识别是否存在某种疾病特定 的控制肿瘤生长的基因、基因谱或蛋白,以此确定针对特异性靶点的一 种治疗方法。随着对脑胶质瘤分子病理机制了解的深入,越来越多的分子被当作分子靶标,并开发出相应的靶向治疗方案。
(一)EGFR控制剂
作为明星癌基因,EGFR是较前沿入到人们视野中的分子靶标。如 前所述,EGFR扩增、突变和重排等变异形式,都可较终导致EGFR通路 的过度激活。在临床前实验中,EGFR控制剂吉非替尼和厄洛替尼都曾 显示出良好的抑瘤效果,但临床试验往往收效甚微。
(二)FGFR控制剂
美国哥伦比亚大学Antonio教授和MD Anderson肿瘤中心Zhang Wei 教授在学界报道,在原发性GBM中稳定存在FGFR3-TACC3融合基因。Antonio教授进而针对此融合基因进行了靶向控制,收到了良好的 临床前期实验效果,FGFR控制剂瑞戈非尼的Ⅱ期临床试验也证实能够 提高复发脑胶质瘤患者的OS和PFS。
(三)VEGF控制剂
贝伐单抗(bevacizumab)作为抗血管生成控制剂,是VEGF的靶向 拮抗剂,其针对GBM的治疗效果饱受众人期待。然而,RTOG 0825和 AVAglio两项Ⅲ期临床研究均证实,贝伐单抗虽能短期好转患者的生存 状态,延长患者PFS,但并不能好转GBM患者OS。由于贝伐单抗主要 是作用于新生血管,也易控制正常新生血管的形成,会导致一些不良反 应。因此,应用贝伐单抗治疗的患者在短期内(1个月)不宜再次手术 治疗,以免影响手术切口愈合。
(四)MET控制剂
MET基因变异在继发性GBM中相对较多,而在原发性GBM中相对 较少,因而针对MET的靶向治疗研究不如EGFR。国内江涛教授项目组 在国际上报道了PTPRZ1-MET融合基因,确定了MET通路激活在继 发性GBM中扮演重要角色,并设计了MET小分子控制剂伯瑞替尼 (PLB-1001),Ⅰ期临床试验结果显示伯瑞替尼能好转患者的随访终点。
八、电场治疗
肿瘤电场治疗(tumor treating fields,TTF)是一种通过控制肿瘤细 胞有丝分裂发挥抗肿瘤作用的物理治疗方法,用于脑胶质瘤的电场治疗 系统是一种便携式无创设备,通过贴敷于头皮的转换片产生中频低场强 肿瘤治疗电场。2017年Journal of the American Medical Association发布一 项关于新诊断GBM电场治疗的随机对照Ⅲ期临床试验,研究显示电场 治疗联合TMZ辅助化疗与TMZ单纯化疗相比,可以延长患者中位 生存期和5年生存率,而不增加治疗相关的全身毒性,同时还能提高患 者健康相关生活质量(health-related quality of life,HRQOL)。因此, 电场治疗顺利合适,可用于新诊断GBM的辅助治疗。
九、免疫治疗
肿瘤免疫治疗是应用免疫学原理和方法,提高肿瘤细胞的免疫原性 和对效应细胞杀伤的敏感性,激发和增强机体抗肿瘤免疫应答,并应用 免疫细胞和效应分子输注宿主体内,协同机体免疫系统杀伤肿瘤、控制 肿瘤生长。
程序性细胞死亡因子1(PD-1)是一种共刺激分子,属于 CD28/CTLA-4家族。PD-L1广泛分布于组织中与PD-1结合后通过控制 T、B细胞活性来防止自身免疫疾病的发生。PD-1/PD-L1是肿瘤细胞逃离机体免疫杀伤的重要免疫控制靶点,目前研究证实,在脑胶质瘤病灶中存在相当数量的肿瘤浸润淋巴细胞,而且与低级别脑胶质瘤相比, GBM中的PD-1/PD-L1表达量明显升高,这成为抗PD-1/PD-L1治疗脑胶 质瘤的理论基础。PD-1控制剂包括纳武单抗(nivolumab,opdivo)、帕 姆单抗(pembrolizumab,keytruda),PD-L1 控制剂包括阿替珠单抗 (atezolizumab)、度伐单抗(durvalumab)、阿维单抗(avelumab) 等。
目前,关于PD-1/PD-L1控制剂治疗原发和复发GBM的多项临床试 验正在进行之中。CheckMate-143研究是PD-1控制剂治疗GBM的随 机Ⅲ期临床试验,该试验入组患者为放疗和TMZ治疗后一次复发的 GBM患者。2017年4月公布的研究结果显示,与贝伐单抗治疗对照组相 比,纳武单抗并不能使复发GBM患者的总生存期获益。 CheckMate-498研究是一项随机、多中心Ⅲ期临床试验,在MGMT非甲 基化的新诊断GBM患者中比较纳武单抗+放疗组与TMZ+放疗组的疗效 和顺利性差异。该研究中,患者手术后被随机分为两组。纳武单抗+放 疗组患者接受每2周1次的纳武单抗静脉滴注,随后变为每4周1次的纳武 单抗维持治疗,直到疾病进展或出现不可接受的毒性;对照组接受TMZ 化疗+放疗。2019年5月公布的研究结果显示,纳武单抗+放疗组较对照 组未能明显好转患者总生存期。CheckMate-548也是一项随机、多中心 Ⅲ期临床试验,在MGMT甲基化的新诊断GBM患者中评估纳武单抗联 合标准方案(TMZ+放疗)相对于单纯标准方案的疗效和顺利性。2019 年9月公布的研究结果显示,与标准方案相比,纳武单抗联合标准方案 未能好转患者无进展生存期,该研究仍在按计划进行,用以评估另 一个主要终点——患者总生存期的差异。因此,随着研究进展,免疫治疗作为一项治疗手段,将会在脑胶质瘤领域取得更大突破,免疫治 疗与现有治疗方式联合有望成为治疗脑胶质瘤的重要手段之一。
十、术后治疗临床试验汇总
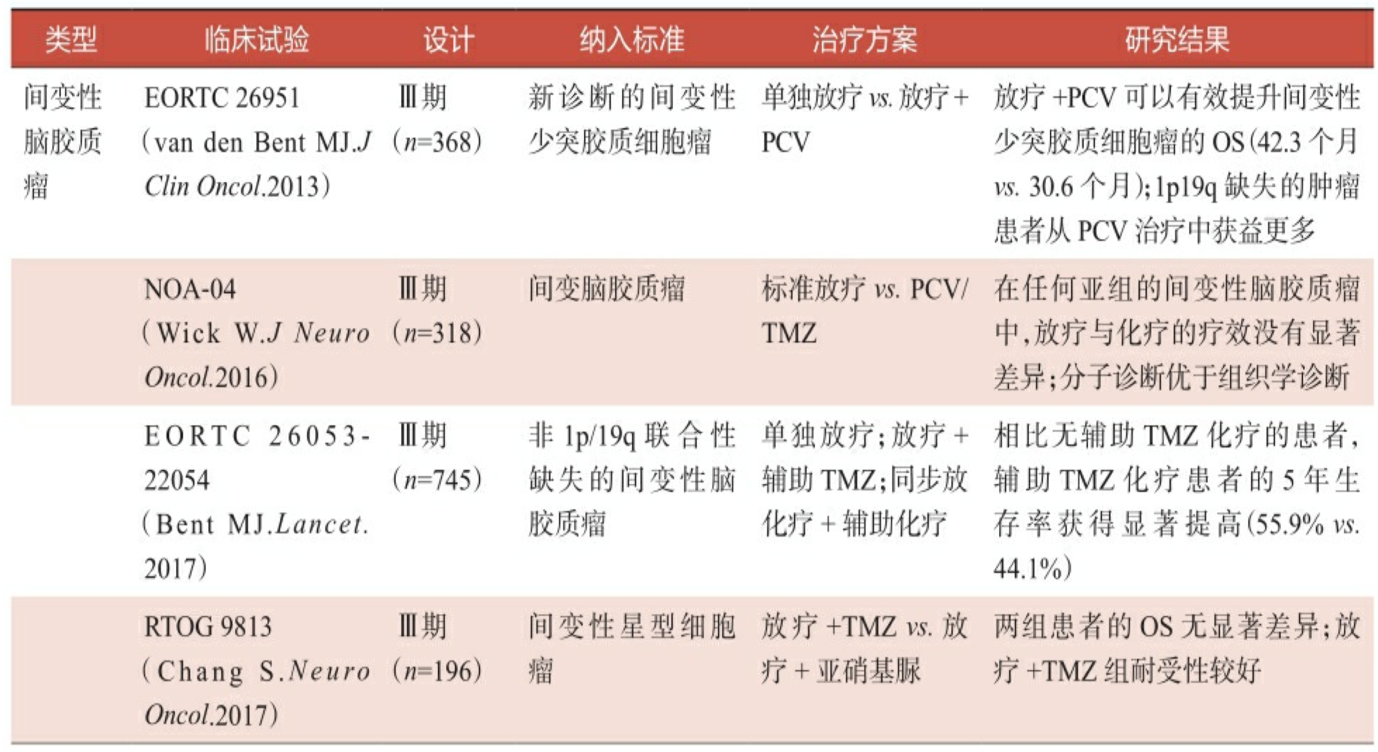
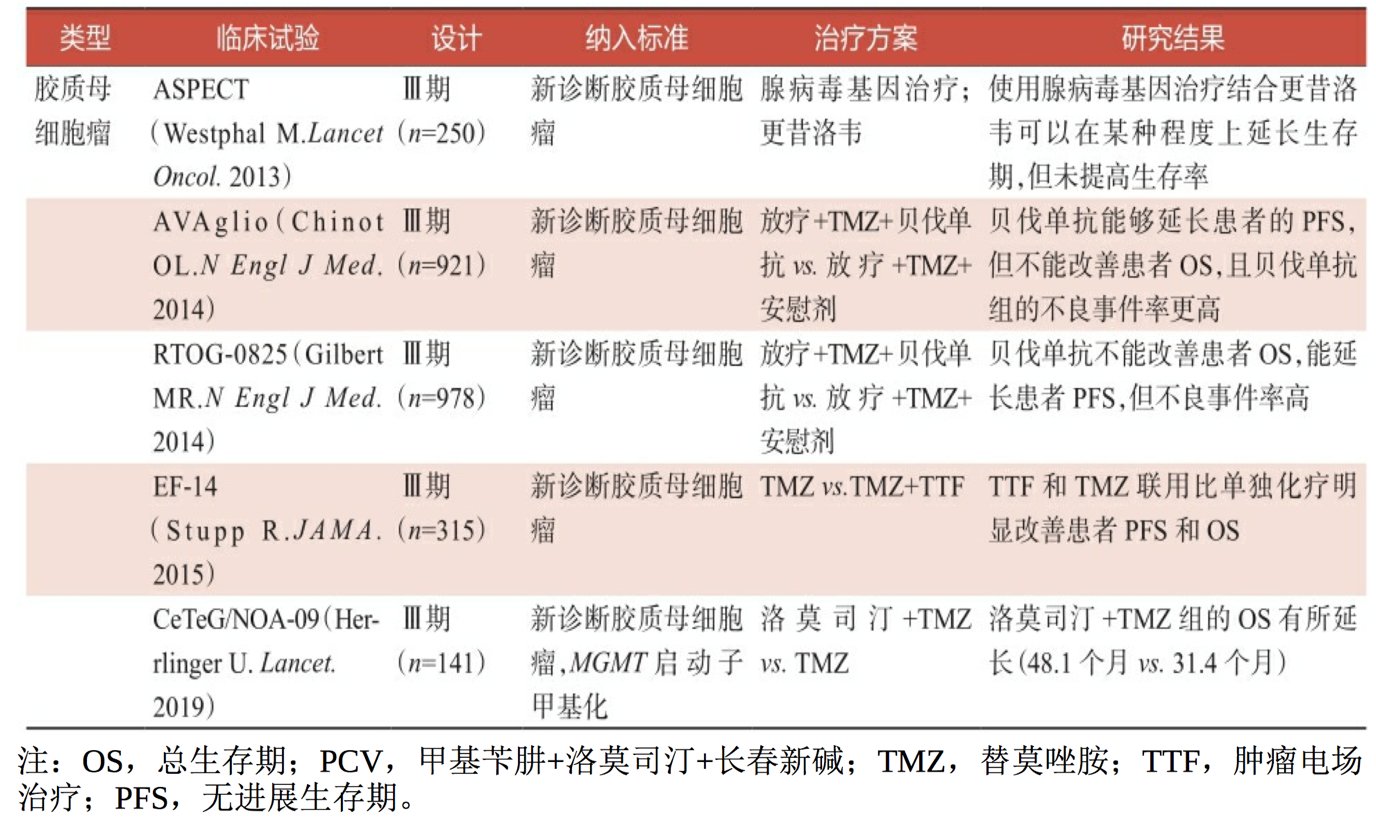
高级别脑胶质瘤即使经过了手术全切除,其复发率仍然很高,术后辅助治疗一直是临床医师和研究人员关注的热点。表3-2总结了近年来 高级别脑胶质瘤术后辅助治疗的相关Ⅱ~Ⅲ期临床试验,包括单独放疗、放疗或辅助化疗、同步放化疗+辅助化疗等。
表:高级别脑胶质瘤术后辅助治疗临床试验汇总
十一、高级别胶质瘤咨询流程总结
高级别脑胶质瘤的咨询流程
如上文所述,高级别脑胶质瘤经多个临床试验总结后,目前已经形 成了较为统一的治疗方案,而临床医师可根据患者具体情况进行调整。 而WHO Ⅲ级间变性脑胶质瘤和GBM的咨询流程见下图。
参考文献:国家神经系统疾病临床医学研究中心.中国脑胶质瘤临床管理指南.2020版.
- 文章标题:高级别脑胶质瘤的治疗,较新指南怎么说?
- 更新时间:2021-04-14 10:17:38

 400-029-0925
400-029-0925