●具体手术案例展示
胶质瘤切除在颅内显微外科⼿术中经常遇到。⼿术的⽬的有两个:在 保留神经功能的前提下尽可能多的切除肿瘤;获得准确的肿瘤病理诊断分 级。除了⼀些I级的肿瘤,胶质瘤并不能通过⼿术治愈。另⼀⽅⾯,借助良 好的显微技术是可以较⼤限度的切除肿瘤,⽽不会造成周围正常脑组织的 损害。
⼀般来讲,由于胶质瘤边界不清,较具挑战性的是如何确定肿瘤切 除的范围,这在功能区肿瘤的切除过程中显得尤为重要。⼿术所致的新的 神经功能障碍将会降低患者术后的⽣活质量,甚⾄有迹象表明,它们可能 会缩短患者的⽣存期。从显微外科⼿术的⾓度上讲,可将胶质瘤分为两个 主要类型:①低级别胶质瘤(I级和II级);②⾼级别胶质瘤(III级和IV 级)。这两个类型的胶质瘤的质地和⾎供不同,其⼿术⽅法亦稍有不 同。当然,⼿术⽅法的选择还要考虑到⼿术可能带来的益处及并发症。
低级别胶质瘤的⼿术策略
对于低级别胶质瘤,我们会更激进地切除肿瘤,⽽⾼级别胶质瘤的切 除则⽐较保守。与⾼级别胶质瘤相⽐,⾁眼全切低级别胶质瘤所带来的好 处会更多,⽣存期也会更长⼀些。有些I级的胶质瘤可以通过全切⽽治愈。 低级别胶质瘤肿瘤组织本⾝亦与⾼级别胶质瘤不同,它的颜⾊通常⽐周围 脑组织稍⽩⼀些,可以略有弹性,⽽切除时出⾎也不多。此外,它不包含 坏死组织但肿瘤⾃⾝可能是囊性的。
⼿术⼊路及开颅⽅式的选择以良好暴露肿瘤为⽬的。对于接近⽪层的 肿瘤,需充分暴露整个肿瘤及其边界。⽽对于深部肿瘤,开颅需确定 能够到达整个肿瘤,因为⼿术的⽬标是尽量全切肿瘤。当然,因为胶质瘤 都是浸润性⽣长,这就不可避免的会有⼀些肿瘤细胞残留。如果肿瘤位于 ⼀个相对顺利的部位,例如额叶前部或颞较,我们可以切除肿瘤边界之外 ⼏厘⽶的脑组织。当然,如果肿瘤位于功能区,我们还是应该紧邻肿瘤边 界切除。
硬膜剪开后应⾸先释放脑脊液,待脑组织塌陷了便于操作。在⼤的肿 瘤切除时尤应如此,脑组织的塌陷不有助于更好的暴露肿瘤,也有助于 进⼊⼤的脑池⽽进⼀步释放脑脊液。将肿瘤的边界、范围和周围的解剖结 构搞清楚后才能开始切除肿瘤。切除肿瘤时应尽量沿着脑沟、脑回这些⾃ 然的解剖界⾯进⾏,并保留过路⾎管。双较电凝并切断⽪层的⾎管,结合 吸引器逐渐进⼊脑内,沿肿瘤边界边电凝边吸除肿瘤组织。超声吸引⼑可 能有助于低级别胶质瘤的切除,因为低级别胶质瘤⾎供并不丰富。但是, 在使⽤超声吸引⼑时应避免损伤⼤的动脉和静脉。有时候,为了更好地到 达肿瘤的边界需先⾏瘤内减压。当肿瘤的主体部分被整块或分块切除后, 再⾏肿瘤边界部分的切除,此后应进⼀步严格检查瘤腔,尽量避免残留, 较终使瘤腔壁看起来和正常脑组织差不多。肿瘤切除后,严格⽌⾎,瘤腔 壁上以速即纱覆盖。较后⾏标准关颅。
⾼级别胶质瘤的⼿术策略
对于⾼级别胶质瘤,⼿术治疗只是整个治疗过程中的⼀部分。我们⽬ 前的治疗原则是,术中尽可能多的切除强化的病灶,当然如果可以不损伤神经全切那自是更佳,术后⾏放疗或化疗。 每个病例都将在我们的神经肿瘤学组进⾏讨论,⽽这个神经肿瘤学组则由 神经外科医⽣、神经放射学专家、神经病学专家、神经病理学专家和神经 肿瘤学专家共同组成。⼿术本⾝的⽬的是切除肿瘤,但同时要减少神经系 统并发症的发⽣,因为术后神经功能障碍可能缩短患者的⽣存期。
⽬前, 在许多的医疗中⼼,对⾼级别胶质瘤的⼿术治疗多以适度的内减压为⽬ 的。⽽在我们的医疗中⼼,如果我们决定⼿术治疗,我们将尝试全部的技 术,在保留肿瘤周围结构的同时尽较⼤可能提⾼强化灶的切除率。⼿术⼊路的选择以能较佳暴露肿瘤为原则。⾼级别胶质瘤通常⽐低级 别胶质瘤的⾎供丰富,这在制订⼿术⽅案的时候应该注意。术中我们可以 通过释放脑脊液、肿瘤内减压或释放肿瘤内部的囊液⽽获取更⼤的操作空 间。
刚切开肿瘤的时候的出⾎,多由肿瘤外围的病理性⾎管引起,肿瘤的 中⼼部位通常⽆⾎供,⽽多为坏死和囊变。⾎供丰富的肿瘤组织往往⽐周 围脑组织⾊泽更暗或偏红,⽽坏死的部分则多为黄⾊并可能含有静脉⾎ 栓。恶性胶质瘤⾎供丰富⽽有明显的出⾎倾向,这就限制了术中超声吸引 ⼑的应⽤。为此,我们在切除肿瘤的时候通常⽤右⼿持钝头双较连续电凝 肿瘤,⽽左⼿持吸引器反复轻轻吸除肿瘤。利⽤这种技术可以达到更好的 ⽌⾎效果。
对于浅表的⾼级别胶质瘤,切除的⽅式与动静脉畸形⾮常相似,应该 沿着肿瘤边界连续电凝⽌⾎,如⾮减压所需则应尽量避免进⼊肿瘤中⼼部 位,这样就能确定较少的出⾎。然⽽,对位于功能区或⽪层下的肿瘤,我 们则采⽤不同的切除⽅式。我们会直接进⼊肿瘤,并由内到外切除肿瘤, 并尽可能少的牵拉周围功能区组织。连续使⽤双较电凝可以确定较少的出 ⾎,⽽始终在肿瘤组织内部操作则不易造成新的神经功能缺损。靠近肿瘤 边缘的操纵是⽐较棘⼿的,因为和低级别胶质瘤⼀样,胶质瘤的浸润性⽣ 长⽅式必然导致肿瘤组织的残留。但⼀旦肿瘤的强化部分被切除后,创⾯ 多不再出⾎,此时周围组织便类似于正常⽩质了。5-ALA结合合适的显微 镜成像系统的应⽤有助于确认肿瘤强化灶的边界。与低级别胶质瘤的⼿术 原则⼀样,全部的过路⾎管都应保留。尽我们所能将肿瘤切除后,严格⽌ ⾎,瘤腔壁上以速即纱覆盖。
常规逐层关颅。对于⼆次⼿术并接受过放疗的患者,因头⽪萎缩变 薄,术后⽪下积液和脑脊液伤⼜渗漏的发⽣率很⾼,为此,⽪下组织及⽪ 肤的缝合要更为仔细。通常,我们会推迟拆线时间,甚⾄要等数周待伤⼜ 愈合后才能拆线。
手术⼊路
在胶质瘤⼿术中,肿瘤的位置决定⼿术⼊路的选择。我们可以采⽤不同体位(仰卧位、侧卧位、半坐位以及俯卧位),⽬的是 能够通过颅内的原有解剖间隙到达肿瘤⽽尽可能⼩地损伤周围脑组织。开 颅不仅要确定对肿瘤的良好暴露,还应确定在操作空间不够的情况下便于 脑脊液的释放。当然,⽆论采取哪种体位,⼀定要确定头部⾼于⼼脏平 ⾯,这样利于静脉引流⽽不⾄于造成明显的脑⽔肿。
对于⽪层的肿瘤,⾻窗和硬膜剪开的范围应能充分暴露整个肿瘤及其 边界,⽽对于深部肿瘤,可通过⼩⾻窗结合锁孔技术达到相同的⽬的。当 然,因为胶质瘤都是浸润性⽣长,这就不可避免地会有⼀些肿瘤细胞残 留。
⽪肤切⼜的设计要充分考虑到恶性胶质瘤患者可能需要接受术后放 疗。直切⼜和稍微弯曲的切⼜能得到更丰富的⾎供⽽愈合良好,但窄蒂⽪ 瓣可因⾎供不⾜⽽愈合不良。
术中肿瘤的定位及肿瘤边界的确定
胶质瘤具有浸润性⽣长的特点,这就造成术中肿瘤的定位及肿瘤边界 的确定⾮常困难。对于表浅的肿瘤,肿瘤组织本⾝颜⾊较深⽽易于辨认, 但其边界不清,术者需确定哪⾥是肿瘤组织和哪⾥是正常组织。
只要条件允许,我们均会尝试以⼀些解剖结构如某些原有平⾯及⾎管 结构为标志物进⾏定位,⽽术中应根据具体情况进⼀步定位,如每遇到⼀ 个特定的解剖结构就应暂停。然⽽,通常情况下,并不⼀定存在特定的解 剖结构供我们作定位参考,此时唯有依靠术者的3D想象⼒结合仔细检查及 尺⼦等⼯具的利⽤,甚⾄依靠纯粹的直觉进⾏定位。根据术前影像对肿瘤 的测量,与术中的即时测量相⽐较,往往能够很好地估计肿瘤的切除范 围。肿瘤切除之前,术者需要对肿瘤和全部可能伤及的结构有⼀个尺⼨上 的估量,因为在肿瘤切除的过程中⼏乎是⽆法定位的。我们在低倍镜下进 ⾏较初定位及观察,⽽在⾼倍镜下切除肿瘤。我们进⼊到⼀个更⾼的放⼤ 倍率。如果在肿瘤切除的过程中⽆法定位了,低倍镜下仔细的测量通常会 有帮助。
对于功能区附近的肿瘤,我们习惯于神经导航的应⽤。在硬膜刚打开 时可以借助神经导航确定肿瘤边界并制定⼿术⼊路,⽽在脑脊液释放或部 分肿瘤切除后神经导航就不准确了。
肿瘤切除
胶质瘤切除的技术要点是:⽤双较电凝不断灼烧的同时反复⽤吸引器 轻轻吸除肿瘤组织。与超声吸引⼑不同,双较电凝在分离肿瘤组织的同时 也能⽌⾎。只要发现出⾎,要严格⽌⾎后再继续后⾯的操作,因为⼀旦切 除⾯积增⼤,⼩的渗⾎会形成⾎泊⽽变得难以处理。我们经常⽤⽣理盐⽔ 冲洗术区,这样有助于发现⼩的出⾎点。
我们经常⽤脑棉标记不同的肿瘤界⾯,这有助于从不同⽅向向同⼀个 肿瘤界⾯进⾏分离。与此同时,脑棉可以压迫切⾯⽽减少渗⾎。此外,当 切除界⾯扩⼤的时候,脑棉可以防⽌瘤腔塌陷⽽便于剩余肿瘤的切除。
在胶质瘤的⼿术过程中,有必要采取多个有代表性的肿瘤标本。我们 可以在肿瘤边缘留取⼀些标本,⽽每当肿瘤质地发⽣变化时都要留取标 本。标本可即⾏冰冻切⽚病理检查,但通常需要⼀个星期左右才能获得肿 瘤的较终分级结果。
巴特朗菲教授案例展示
1、巴教授良性胶质瘤手术切除案例
30岁女士脑干中脑胶质瘤,手术全切后9年未复发
基本情况:30岁女士,有复视和轻微右侧偏瘫

术前:a、b图患者术前MRI显示中脑肿瘤,患者较初接受立体定向囊肿抽吸和间质放疗,并被诊断为毛细胞型星形细胞瘤,但肿瘤仍在生长。

术后:无手术并发症,f图显示伤口愈合正常,患者预后良好,无神经功能缺损。组织病理学检查为1级毛细胞型星形细胞瘤。g、h图术后MRI影像显示,肿瘤全切。随访MRI记录手术后9年无肿瘤复发。
2、巴教授恶性胶质瘤手术切除案例
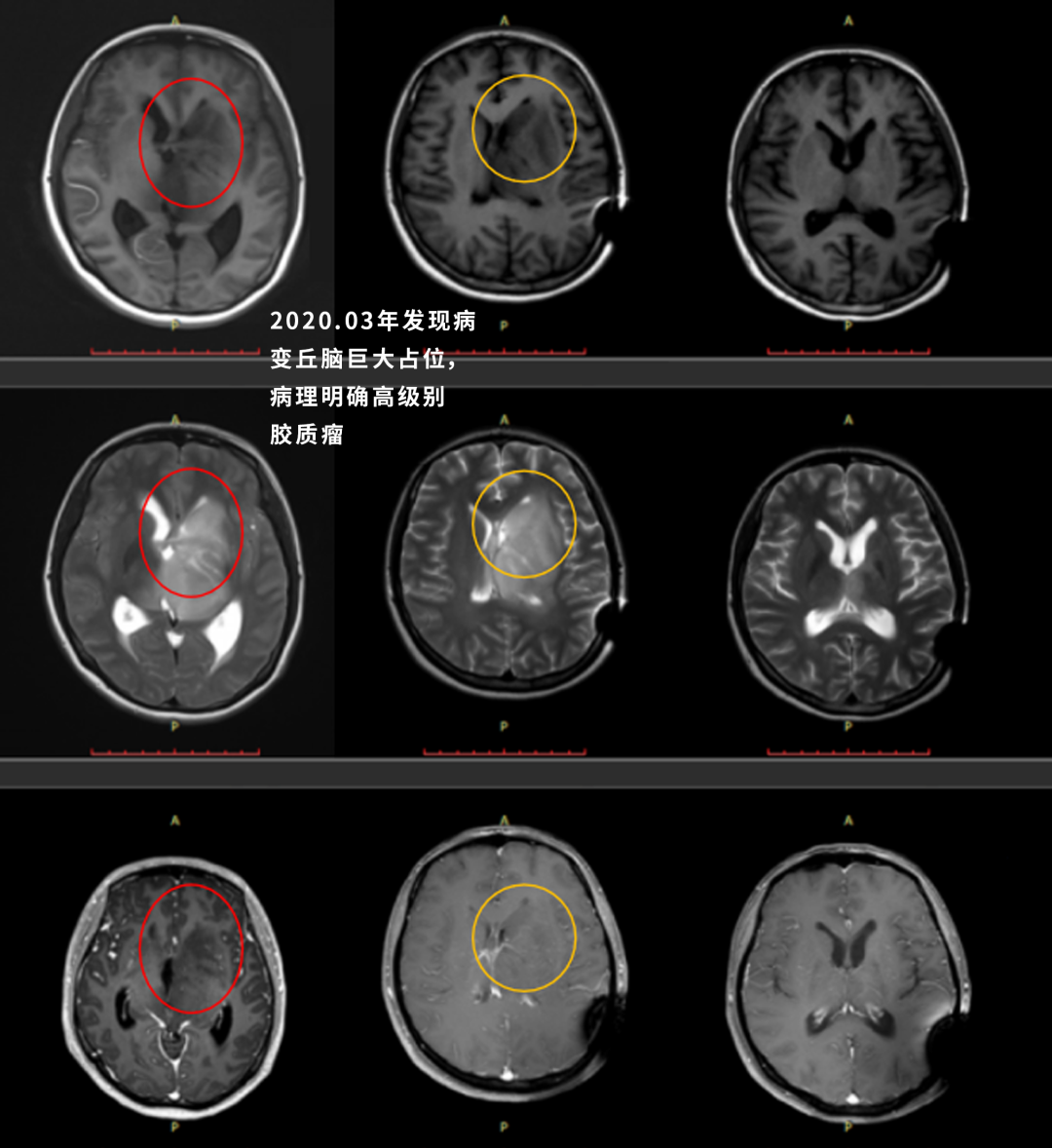
钢琴家患丘脑胶质瘤,手细致功能障碍、全切肿瘤后日渐恢复
基本情况:Z女士,右手细致活动限制,头部右侧和右脚麻木感,也偶有视力模糊、有雾感。

术前:术前MRI显示较大丘脑占位,肿瘤压迫导致明显体征。
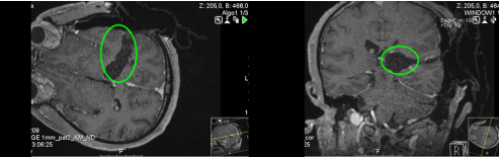
术后:术中磁共振检查,显示肿瘤准确全切。手术顺利,无手术并发症。术后组织病理学检查弥漫性中线神经胶质瘤,WHO 4级。患者术后当天即拔出气管插管,无任何问题。术后3天即在物理治疗下增加康复锻炼,下地锻炼,术后5天即可自行站立行走。术后半年复查,肿瘤没有复发,患者症状好转。
资料来源:Helsinki Microneurosurgery Basics and Tricks.
- 文章标题:质地、⾎供、侵袭性不同,谈良、恶性胶质细胞瘤的手术策略
- 更新时间:2021-03-19 16:59:23

 400-029-0925
400-029-0925