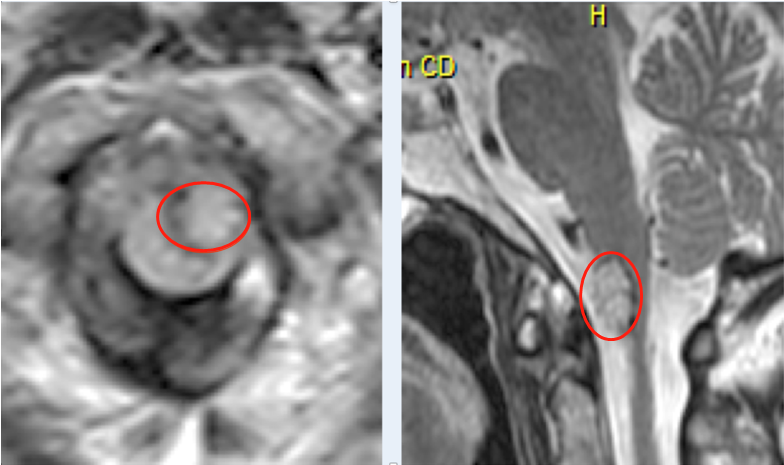
组素修饰与胶质瘤的发生有关。伴随着我国经济的发展,人民生活水平的提高,老龄化程度的加剧以及环境因素的改变,脑肿瘤已经成为危害人类健康的十大恶性肿瘤之一,且发病率不断增加。神经胶质瘤是较常见的颅内恶性肿瘤,发病率占全部肿瘤的40%~50%,1~30%患者生存期在1年左右,5年不到5%。
神经胶质瘤表现为浸润性生长,与正常脑组织无明显分界,在临床上很难完全切除;由于血脑屏障的存在,对放疗和化疗均不敏感,因而具有高致死率、高致死率等特点。神经胶质瘤,是高级胶质母细胞瘤,目前缺乏合适的治疗方法。对神经胶质瘤发病机理的深入研究,对于寻找新的治疗靶点和方法具有重要的理论和现实意义。基因的表观修饰,如组蛋白修饰,对于调节包括神经胶质瘤在内的发育和肿瘤至关重要。
Liu等通过染色质免疫共沉淀结合基因测序的方法发现表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR(缺失2~7外显子缺失)的胶质瘤细胞能促进组蛋白H3赖氨酸甲基化(H3K4me1)和乙酰化(H3K4me1),特异性上调SOX9和FOXG1转录因子,使其增强后基因的表达增强,引起胶质瘤恶性增生及浸润。胶质瘤细胞在营养限制条件下激活AKT,并使组蛋白H4乙酰化(AcH4)水平升高和稳定。
Kitange等对化疗药物temozolomide,TMZ,Kitange等对胶质瘤化疗药替莫唑胺(temozolomide,TMZ)的抗肿瘤活性也上调,组蛋白3甲基化(H3K9me2)降低(H3K9me2)表达有相关性。然而,组蛋白乙酰化调节神经胶质瘤发展的机制尚不明确。前期研究发现胶质瘤的增殖与胶质瘤干细胞的干性维持受多种信号途径的调节。
对EGFR具有高活性的神经胶质瘤患者标本,EGFR高活性促进膜受体蛋白DCBLD2与TRAF6结合,AKT的泛素化活化,促进胶质瘤细胞干性保持。临床上,PDGFRA在血小板生长因子受体PDGFRA高表达的胶质瘤患者中,SRC被激活,能提高交换因子DOCK180的磷酸化和活性,促使RAC1活化,加速胶质瘤细胞的迁移和侵袭。同时还发现PDGFRA可调节胶质瘤细胞上皮-间质转化和细胞干化。
近来,研究人员发现,组蛋白乙酰化修饰调控癌基因转录从而诱导神经胶质瘤增殖和肿瘤干细胞干性维持。在EGFR及其胶质瘤的基础上,采用RNA-Seq、ChIP-Seq、ChIP-Seq及颅内原位肿瘤模型等方法对EGFR及其胶质瘤常见突变体EGFR受体活化特异上调组蛋白III的23位赖氨酸(H3K23ac)。H3K23乙酰化水平增加时,三基序家族蛋白TRIM24与染色质结合,TRIM24与H3K23ac结合在H3K23ac的C端上。TRIM24作为转录因子共激活子,通过其N端三基序结构和STAT3结合,稳定和激活STAT3转录活性,调节下游途径的活化,导致胶质瘤恶性增殖。
从临床来源获得的神经胶质瘤干细胞系进一步研究发现,EGFR上调的H3K23乙酰化对胶质瘤干细胞的干性维持有重要作用。对EGFR/H3K23ac调控的STAT3的转录活性进行控制,并对TRIM24对H3K23ac调控的STAT3的活性以及胶质瘤干细胞的扩增和干维持作用。临床肿瘤标本的EGFR磷酸化、TRIM24表达及STAT3磷酸化均发生了同步变化。此外,在高磷酸化、TRIM24高表达和高水平STAT3磷酸化的神经胶质瘤患者预后不良。本研究揭示了组蛋白乙酰化参与脑胶质瘤发生发展的表观遗传调控新机制。与此同时,该研究发现TRIM24不仅是一种潜在的临床诊断指标,也是一种肿瘤治疗的合适靶点,同时也是EGFR高扩展性突变患者。由TRIM24调控的22个基因簇有可能成为发展临床评估脑胶质瘤的新途径。
- 文章标题:组素修饰与胶质瘤的发生有关。
- 更新时间:2021-11-10 16:28:29

 400-029-0925
400-029-0925