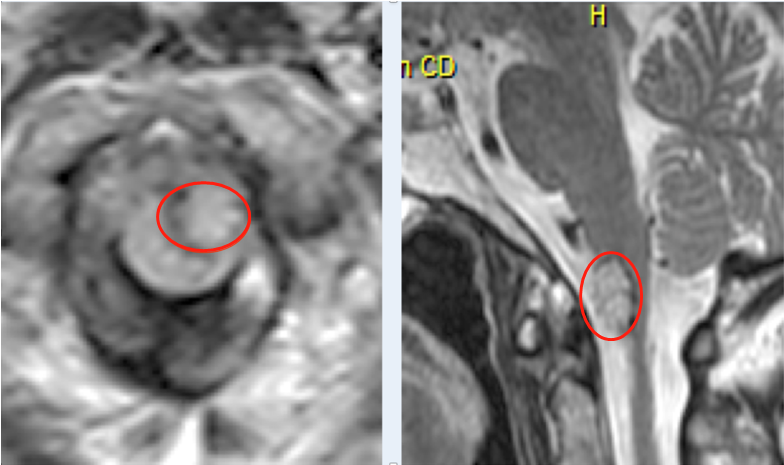
胶质瘤是成人中常见的原发性脑瘤。治疗方法取决于肿瘤的组织学、分子亚型和分级以及临床因素,如患者特征和肿瘤的手术可行性。国际卫生组织根据假定的细胞来源对胶质瘤进行分类。多数可能来自星形细胞谱系(星形细胞瘤)或较少出现的少突胶质细胞。更少见的子类型也存在。

WHO (I - IV)分级往往与预后息息相关。WHO I级胶质瘤,如发生在儿童人群中的毛细胞星形细胞瘤,通常可通过切除治疗。WHO II - IV级胶质瘤是弥漫性浸润性肿瘤,不能在显微镜下完全切除,至今仍无法治愈。WHO I级和II级肿瘤都被认为是低分级的,患者常常将其视作良性胶质瘤,但一经发现也要及早治疗,否则低级别胶质瘤也会发展为高级别、恶性胶质瘤。
致使良性胶质瘤快速增长的风险因素
由于治疗结果取决于宿主(年龄、症状)和肿瘤(大小、生物标记)因素,因此治疗对象、治疗时间和治疗方法是人们感兴趣的领域。例如,皮格纳蒂及其同事发表了一套临床标准,以更好地识别预后较差的患者,称为低级别胶质瘤。因素包括:患者年龄大于等于40岁,术前胶质瘤较大直径6厘米,肿瘤越过中线,术中神经损害或者术后造成与比手术前更糟的结果。
这5种危险因素中有3种及以上的患者为高危亚组,与有2种危险因素的患者相比,总生存期较短。这些标准是由欧洲癌症研究和治疗组织(EORTC)进行的两项大型放射治疗研究的患者制定的。进一步的独自队列调查证实了这些标准,低风险组在总体上有统计学上的好转(10.9年vs 3.9年;P=0001)和无进展生存期(6.2年vs 1.9年;P=0001),并认为组织学亚群、组织学和肿瘤大小是主要的风险驱动因素。其他12个临床因素包括微创状态评分和切除范围也被发现是独自的预后因素。
关于良性胶质瘤的放化疗
当进行放射治疗时,所需剂量(约50戈瑞)低于用于高级别肿瘤的剂量(约60戈瑞),且不会影响生存率,而且毒性较小。然而,EORTC 22485报告的生存期约为7.3年,无论诊断时是否进行了放疗或疾病进展。因此,推迟放射治疗似乎并不会影响生存率,而且对某些患者来说推迟放射治疗可能是合理的。类似地,EORTC较近的数据表明,初期用替莫唑胺(不放疗)治疗后的无进展生存期与放疗(不化疗)相似,尽管结果受到分子亚群的影响,且生存期数据尚不成熟。这一发现使一些研究者倾向于替莫唑胺作为延迟放疗的初始策略。然而,替莫唑胺也能引起肿瘤分子结构的改变。
1998年,RTOG启动了一项II期观察性研究,研究对象为低风险低级别胶质瘤患者,定义为年龄小于40岁且切除后无残留疾病(神经外科医生定义)。这些患者未接受进一步的辅助治疗,2年和5年总生存率分别为99%和93%;但超过50%的患者在5年内出现明显的肿瘤生长,远高于预期。进一步分析发现术前肿瘤大小(4cm),星形细胞组织学和脑成像上残留疾病大于1cm的证据都预示着更短的无进展生存期。
然而,对于存活5年以上的患者,提前治疗会产生不良后果。因此,对于那些低风险疾病的患者,完全推迟治疗可能是合适的:小于40岁的患者,术后MRI上的残留疾病小于1cm,且具有良好的组织学和分子特征,特别是WHO II级少突胶质细胞瘤(IDH突变,1p/19q共删除)。例如,在RTOG 9802中,少突胶质细胞瘤患者联合放疗+PCV的中位生存期超过13.3年(中位生存期未达到),单独放疗的中位生存期为10.8年。在这段时间内,放疗造成神经认知损伤的风险不容忽视,神经认知能力下降已被证明对生活质量有负面影响。
总结
关于良性胶质瘤的治疗,我们能够明确的治疗理念仍是“先行手术切除”,INC德国巴特朗菲教授曾为很多低级别胶质瘤患者行全切手术,术后很多患者甚至无需接受放化疗,只需定期复查即可。而且,即使是对于恶性脑瘤来讲,手术也是一线治疗手段,术后辅以放化疗可获得更好的效果。国内患者可拨打400-029-0925咨询INC国际专家沟通病情、评估手术风险。
相关资料来源:DOI:10.1016 / j.nec.2018.08.007
- 文章标题:良性胶质瘤需要手术吗?化疗优选哪些药物?
- 更新时间:2021-03-19 10:52:20

 400-029-0925
400-029-0925