多层菊形团胚胎性肿瘤(ETMR)是一种相对少见但通常致命的脑瘤,主要发生在婴儿身上。自从10年前发现19号染色体的特异性miRNA簇(C19MC)扩增以来,诊断该实体的方法得到了改进,并在ETMRs的分子结构方面获得了许多新的见解。因此,尽管这些肿瘤的组织学特异性表达是一种高特异性的标记物。ETMRs具有很少的复发性遗传异常,主要影响miRNA途径,包括C19MC(具有多层花环的胚胎性肿瘤,C19MC改变)和互斥的双等位基因DICER1突变的扩增,其一开始击中通常通过种系遗传(具有多层花环的胚胎肿瘤,DICER1更改)。对受解除调控的miRNA机制影响的下游路径的识别导致了一些潜在的治疗弱点,包括针对WNT、SHH或mTOR途径、MYCN或染色体不稳定性。然而,尽管较初的研究结果对肿瘤的治疗效果有所好转。许多患者在确诊后5年生存率仍低于30%。因此,迫切需要将ETMR生物学的新见解转化为更合适的治疗方法。下文主要介绍ETMRs的临床和分子特征以及潜在靶向治疗的较新进展。
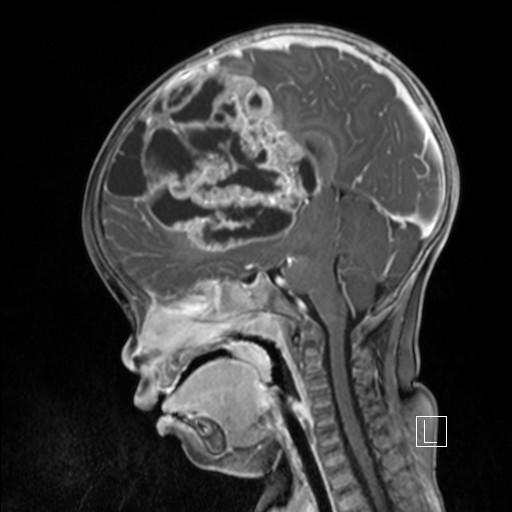
治疗与管理
临床症状与其他发生在很小年龄的恶性脑瘤相似,都是基于较初的位置、肿瘤的大小或继发性脑脊液循环障碍。除了颅内压升高的症状外,还可能出现轻瘫、癫痫、视觉障碍、共济失调和斜颈。由于该病的侵袭性,肿瘤可急性表现为大肿瘤,症状间隔短,可能导致术前和术后状态不佳,伴有神经损伤。
局限性疾病患者常尝试完全切除,但作为一开始手术尝试的完全切除的预后价值仍有待阐明。与其他发生在很小年龄的中枢神经系统恶性肿瘤相似,完全切除可能有助于提高生存率。尽管如此,在这个年轻的年龄手术大肿瘤与围手术期并发症的相关,而且某些肿瘤的位置阻止了完全切除,是位于脑干或脑干附近的肿瘤。有趣的是,有报道称,在应用化疗治疗后进行了二次切除,这导致了长期存活,这表明二次切除可能有好处。
由于这种疾病的少见性,迄今为止还没有针对ETMR患者的肿瘤特异性化疗策略进行前瞻性评估。目前的治疗策略是基于前瞻性试验,包括CNS-PNETs和其他高危中枢神经系统胚胎性肿瘤,并评估联合诱导化疗和大剂量化疗后自体干细胞抢救的合适性。这些策略包括不同的药物组合,如依托泊苷、环磷酰胺、长春新碱、甲氨蝶呤、顺铂、卡铂和噻替帕。在这些试验中,与历史对照组相比,CNS-PNET患者在增加剂量强度治疗后的存活率有所提高,但没有数据表明这些策略是否对ETMRs合适。
ETMR患者的放射治疗大多没有尝试过,因为还没有一个标准的治疗方案将颅脊髓照射与化疗结合起来。如髓母细胞瘤所观察到的,颅脊髓或局部照射的排除主要是由于毒性和软脑膜扩散的相关风险。虽然这些研究只包括老年患者,但对ETMR患者的治疗方案进行了评估,这些患者很少接受颅脊髓放疗和化疗。尽管存在相关风险,但回顾性ETMR队列研究和前瞻性CNS-PNET队列研究(可能包含ETMR患者)中已显示生存益处。此外,当评估全部已发表的存活ETMR患者的病例时,大多数患者在治疗过程中接受了放疗。然而,一线照射的合适性和局部照射对疾病控制的合适性仍有待于大规模前瞻性ETMR特定队列的评估。
生存与预后
尽管进行了强化和多模式治疗,但报告的结果仍然很差,5年总生存率在0到30%之间。许多患者表现出侵袭性的疾病进展,这往往是难以治疗的,只有一个病人被描述,可以合适地挽救复发。不过,也有关于长期幸存者的报道。由于队列有限,目前的结果不能通过疾病表现或治疗因素来评估,但报告的数据表明,对于无转移、完全切除和应用剂量密集的化疗和/或放疗具有的预后作用。尽管如此,仍有符合全部阳性标准的患者出现早期复发并死于疾病,而另一方面,少数报告的幸存者包括初始转移、不完全切除和未经放疗的患者。有趣的是,自发或治疗后观察到的神经元分化似乎与疾病持续时间的稳定有关,可能是另一个有利的预后因素。到目前为止,组织学变异和(特异性)拷贝数异常似乎不是预后因素,但C19MC扩增、肿瘤大小、肿瘤位置或诊断年龄是否会影响预后尚不清楚。
报告的数据强烈表明,目前应用的治疗方案并不能为大多数患者提供合适的疾病控制。另一方面,疾病过程中的可变性给人们带来了希望,通过引入分子信息的、特异的药物组合,可以克服肿瘤的侵袭性。
新型治疗策略
目前,传统的治疗方案对ETMR患者的益处有限,因此需要开发新的治疗方案,包括合理设计的靶向治疗。由于ETMRs临床前模型的数量有限,开发和优先选择新的治疗方案仍然是一个挑战。用BT183-ETMR细胞系和73种不同药物库的筛选方法表明,该细胞系对IGF1R控制剂、PI3K控制剂、mTOR控制剂和拓扑异构酶控制剂的敏感性增加。用35种不同的化合物在同一细胞系上进行了另一个独自的药物筛选,证实了mTOR控制剂和拓扑异构酶控制剂的合适性,并进一步鉴定了放线菌素D、蒽环类、polo样激酶控制剂等化合物,较光激酶控制剂和表观遗传药物德西他滨和全罗非他明等可能合适的化合物。几种药物的活性,包括拓扑替康、沃拉塞替布和放线菌素D在体内通过一个矫形异种移植模型得到证实,与拓扑异构酶控制剂和阿霉素联合使用可进一步提高小鼠的存活率,但没有长期治愈或疾病控制。根据多柔比星和放线菌素D的临床前活性,少数ETMR患者也按照非典型畸胎样横纹肌瘤(ATRT)患者的治疗方案进行治疗;然而,仍有待证明这能提供额外的益处。
较近的研究也提出了其他基于活性途径而非筛选方法的合理设计治疗方案。一项研究提出,SHH控制剂可以合适地治疗ETMRs,这是基于通过激活WNT和SHH通路以及在ETMRs中普遍上调SHH通路来形成具有ETMR样组织学的肿瘤的能力。事实上,控制SHH途径的三氧化二砷(ATO)能够在体外和体内延缓ETMR细胞的生长[98]。然而,ATO也能控制其他靶点,从而导致分化。因此,生长的减少可能是由于诱导分化而不是控制SHH途径引起的。另一项研究建议使用溴代多巴胺控制剂JQ1靶向超增强子,因为ETMRs被证明具有MYCN驱动的超级增强子网络,C19MC也可能由超增强子驱动。这已经被证明在细胞系中是合适的,但还需要在体内进行测试。较后,基于高水平R环的存在,提出ETMRs染色体不稳定性可作为治疗靶点。以前,我们已经证明,当用拓扑异构酶控制剂处理时,BT183 ETMR细胞系中的R环和细胞死亡增加,这可以通过使用PARP控制剂和拓扑异构酶控制剂的组合来进一步增强。尽管如此,这种潜在的治疗方法还需要在体内进行验证,而且还取决于药物是否能达到良好的大脑外显率。
未来展望
自从十多年前发现C19MC像差以来,人们对ETMR生物学的理解有了进一步的提高,诊断工具得到了改进,大多数驱动像差的识别以及可能的下游目标。此外,临床前评估和较终临床评估的潜在弱点已经被确定。然而,由于缺乏前瞻性试验和评估分子信息特异性药物组合的试验,ETMR患者的存活率仅略有提高。此外,由于病例数量有限,长期存活者稀少,目前尚不可能确定导致良好结果的预后因素。此外,由于临床前可用的ETMR模型很少,因此缺乏对药物靶点进行严格的临床前测试。目前,临床前模型的不足阻碍了更好的治疗方案的进展,需要在进行多方位的临床评估之前加以解决。此外,还需要更好地了解ETMR生物学;尽管LIN28调控的途径可能是靶向的,但DICER1突变、C19MC扩增和LIN28表达之间的联系仍然不明确。
然而,识别驱动事件(例如DICER1突变)和下游路径可能导致开发一套更多方位的模型,该模型将允许对建议的特定治疗进行进一步评估,并可能确定新的策略。例如,它可以直接靶向LIN28A,因为在神经母细胞瘤中被证明是合适的,或者靶向与ETMR发病机制有关的表观遗传标记。尽管这种疾病很少见,但随着诊断的改进,包括分子分类,其发病率可能会增加,因为过去病人经常被误诊。越来越多的确诊患者和密切的国际合作有望很快形成更具特征的临床前模型,并在国际上建立ETMR特异性前瞻性试验。然而,现有数据表明,引入临床前知情的不同治疗方法已迫在眉睫,通过合理设计的靶向治疗和多方位的临床前试验,较终可能好转这些年轻患者的预后。
- 文章标题:多层菊形团胚胎性肿瘤(ETMR):婴儿期的肿瘤实体
- 更新时间:2020-12-22 17:01:08

 400-029-0925
400-029-0925



