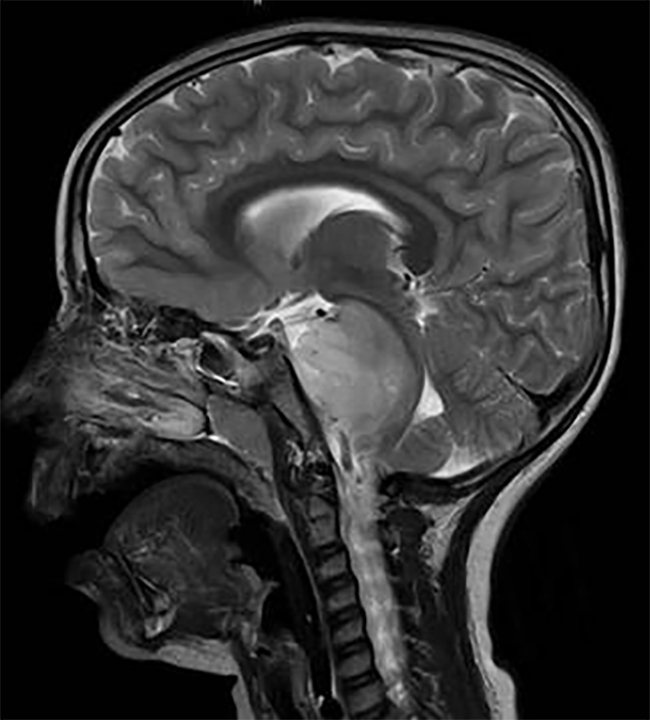
大脑导水管,又称西尔维乌斯导水管,是连接三脑室和四脑室的一条狭窄通道,1650年弗朗索瓦·德拉博伊(Francois de la Boe)首先描述了这条通道,也称为西尔维乌斯(Franciscus Sylvius)。它位于中脑,周围受中脑导水管周围灰质的限制(Emery和Staschak 1972)。它长15-18毫米,直径1-2毫米,因此构成了脑脊液通路较窄的部分,儿童的平均横截面积为0.5平方毫米,成人的平均横截面积为0.8平方毫米(范围0.2-1.8平方毫米)(Russell and Schiller 1949;Emery and Staschak 1972)。神经影像学研究的发展和成熟度以及神经内窥镜的普及使得医生能够在活体中研究其解剖结构,因为在过去,可用的数据来自死后解剖(Longatti等人,2006年,2007年)。

有趣的是,在胎儿期,导水管和神经管的其他部分一样宽,直到中脑周围细胞核的增厚使其管腔变窄。在出生后的生活中,导水管的结构可以分为三个部分。渡槽的一部分是排水沟。在这个水平,中脑的红核突出到通道中,形成所谓的红质隆起,即两个由正中沟隔开的突起。从生理学上讲,子宫内膜呈背三角形,但这种形状在病理条件下可能有所不同。adytum后,上丘水平的通道变窄。三部分再次扩大,称为壶腹。这一部分很重要,因为它与重要的被盖沟有关。在下丘水平,在扩张并进入四脑室之前,通道再次变窄(Cinalli等人,2011年)。
虽然脑脊液从脑室到蛛网膜下腔的净流量存在争议,但通过相位对比MRI研究证实,通过导水管的脑脊液呈脉动层流状流动,在每个心动周期内有收缩和舒张来回位移。使用动态MRI技术估计通过狭窄导水管的脑脊液流速约为10 cm/s(Greitz等人,1992年;Brunelle 2004年;Cinalli等人,2011年)。这种通过导水管的脑脊液脉冲流是缓冲机制的重要组成部分,它确定了所谓的Windkessel效应。事实上,每个收缩期的颅内脑外动脉体积增加了1.5毫升。根据Monro-Kellie学说,颅内隔间内的总容积应保持恒定;因此,该容积部分由脑脊液在大孔处流出(0.8 cc)和部分由静脉流出(0.7 cc)补偿。当脑实质向心室扩张时,通过导水管可以观察到相同的中风,因此,脑收缩容积增加的时间较晚,且较小(0.03 cc),可通过脑室进行补偿。由于脑脊液的存在,脑外动脉的这种扩大可能发生,由于脑脊液,脉搏波被传递到绕过大脑及其毛细血管的静脉,从而确定恒定的血流进入毛细血管床。
导水管狭窄与梗阻性脑积水的病理生理学研究
由于其不同的解剖结构,导水管是脑脊液通路上较常见的梗阻部位,因此,导水管狭窄(as)被认为是梗阻性脑积水的较常见原因。脑积水与AS的关系是1900年由Bourneville和Noir首先提出的(Bourneville and Noir 1900),后来由Dandy和Blackfan的实验(Dandy 1945)证实。根据经典的体流理论,AS引起脑脊液循环障碍,导致脑积水。然而,这种关系可能比近一个世纪以来人们普遍接受的对一只狗的实验要复杂得多。较近的单纯导水管阻塞动物模型导致脑脊液压力和心室扩张不足,表明导水管阻塞本身不会导致高血压急性脑积水的发展(Klarica等人,2009)。此外,AS甚至可能代表了脑积水的一个后果而不是原因。
另一方面,只需人工放大脑室内的脑脊液脉冲,而不限制脑脊液流经导水管和后颅窝内的脑脊液通路,就可诱发羊三室性脑积水。实验性脑积水的生理病理学解释是,脑脊液异常高搏动的力量无法通过导水管充分消散,冲击幕上心室系统,从而导致其扩张和室管膜病变(Di Rocco et al.1978,1979)。这种类型的实验清楚地证明了导水管的狭窄/阻塞对脑积水的发展是不必要的。另一方面,当脑脊液压力(脑脊液脉冲)不能通过狭窄的导水管消散时,这种结构在补偿侧脑室和三脑室的颅内压升高中起着关键作用。
因此,尽管对导水管的合适功能作用的临床和实验观察存在争议,但累积的证据表明,在AS的情况下,导水管的结构变化改变了脑脊液的流动模式,可能会变得紊乱,从而导致心室顺应性(dV/dP比值)降低,这是由于幕上心室与四脑室以及随后与颅脊髓蛛网膜下腔的功能性隔离。
因此,继发于AS的脑积水不能仅仅被认为是脑脊液循环受阻的结果,而是构成颅内压缓冲系统两个组成部分的脑室和蛛网膜下腔之间的分离,根据流体力学理论(Klarica等人,2009)。此外,湍流经狭窄的导水管时,会造成室管膜损伤,促进胶质反应,使AS恶化。
另一方面,AS与颅内压增高之间的关系不是线性的,因为即使有明显的狭窄,颅内压也可能没有明显的升高(Jacobson等人,1999年)。颅内间隔的残余顺应性程度可能会影响颅内压增高的发展,并可能解释与先天性AS相关的某些形式的脑积水,这些脑积水被称为迟发性特发性导水管狭窄(LIAS)或成人长期显性脑室扩大(LOVA)(Oi等人,2000年;Fukuhara和Luciano,2001年)。
根据流体力学理论,在急性期(以颅内压增高为标志)后,由于导水管阻塞,心室扩张和随后的皮质静脉压迫会导致血流动力学改变,这可能有助于部分恢复颅内系统的顺应性,因为静脉充血和脑肿胀会抵消心室扩张,从而导致阻塞性脑积水的慢性期动脉扩张减少,毛细血管容积增加,脑脊液搏动增加,阻塞心室的脑脊液流量增加。在慢性期,脑脊液压力可能会降低,但大脑顺应性的降低将与脉压增加和跨膜搏动应力增加有关,即使平均脑脊液压力正常,也会继续扩张心室(Greitz 2004)。
发病率、病因和分类
AS被公认为脑积水的主要原因之一,占先天性脑积水病例的20%,占儿童脑积水病例的6-66%,成人5-49%(Dandy 1945;Robertson等人,1990)。可细分为内在的或继发于肿块性病变的外源性压迫或变形。固有形式可进一步分为特发性或继发于已知的病理过程。根据历史(罗素1949)和有争议的分类法(Andeweg 1976),可进一步分为四种类型(图1)。狭窄型,管腔由室管膜细胞排列,无胶质增生。这种类型可能是由于发育错误,可能很大水平上从单纯狭窄到闭锁。
在分叉型中,多个独自的通道,无论是连通的还是不连通的,都会减少通过导水管的脑脊液流量。这种情况被认为是由于正中裂不完全融合所致。事实上,分叉有时与其他中线异常有关,如菱形脑性融合、丘融合(中脑融合)、三脑室闭锁(间脑突触症)和胼胝体异常(Adle Biassette et al.2013)。
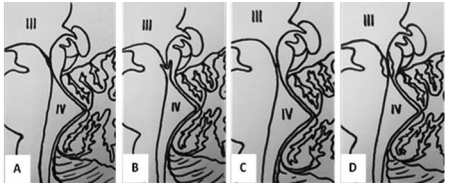
图1,Russell对AS固有形式的组织病理学分类(a,狭窄;b,分叉;c,隔膜形成;d,胶质增生)
中隔形成型室管膜正常,但一般位于通道出口处的胶质膜使导水管闭塞,从而导致通道上入口扩张。在胶质增生型中,位于导水管的室管膜层已不复存在,管腔受到胶质增生的限制,胶质增生对出血、感染或有毒物质有反应。这种分类不应被认为是严格的,因为不同类型的狭窄可能在同一个病人中共存。此外,还使用了其他面额。例如,特发性AS脑积水是指脑脊液通路阻塞位于大脑中脑导水管处的非交通性脑积水,无任何外源性压迫(如肿瘤)和任何已知病因(如脑膜炎或遗传性疾病)(Spennato等人,2013年),这种情况至今仍是较常见的形式。
在已知病因的病例中,大多数是由感染(弓形虫、巨细胞病毒、甲型流感、副流感II、梅毒、流行性腮腺炎病毒等)和/或出血引起的(Jellinger 1986)。二个由频率引起的原因是导水管畸形病理。三个原因是外在压迫,更常见的是肿瘤性而非非肿瘤性(Dahnert 1996)。
可能是先天性的或后天性的,根据发病年龄而定。
先天性AS的发病率估计为0.5-1/1000(Dahnert 1996)。它可以是全部的,也可以是部分的,前者与生命不相容。在此背景下,X染色体连锁导水管狭窄是遗传性脑积水较常见的形式。Bickers和Adams于1949年一次对其进行了描述,也被称为L1综合征(Bickers和Adams 1949)。L1是神经发育过程中必不可少的神经细胞粘附分子,编码L1分子的基因(L1-CAM)突变是导致这种疾病的原因(Fransen等人,1997)。一半受累的男性儿童拇指内收,这一临床发现可能有助于诊断(Graf等人,1998年)。严重智力低下和痉挛性截瘫是该病的其他临床特征。同时出现胼胝体异常(发育不全、发育不良和发育不全)与更严重的神经认知障碍有关(Verhagen等人,2013年)。产前诊断是可能的。事实上,尽管脑积水的诊断是在怀孕18-20周后作出的,但妊娠早期超声图像中的发育不全和拇指内收可能有助于诊断。通过绒毛取样对L1-CAM突变的研究可以证实诊断(Senat等人,2001)。
少见的遗传性疾病可能表现为相关的脑积水。事实上,Fried综合征是另一种X连锁疾病,取决于AP1S2基因的突变(Saillour等人,2007),其主要特征是智力残疾,CT扫描显示基底节铁沉积或钙化(Cacciagli et al.2014),至少部分受累个体出现变异性脑积水伴导水管梗阻(Fried 1972),但其他患者可能有后颅窝囊肿(Tully and Dobyns 2014)。
肌营养不良-肌营养不良性神经病变,如沃克-沃堡和肌眼-脑疾病,也可能伴有脑积水。这些情况是由酶的突变引起的,这些突变导致神经元与细胞外基质的结合缺陷、胶质细胞限制膜异常、神经元迁移中断,从而导致大脑半球出现异常白质的鹅卵石皮质,以及脑干异常,常伴有导水管阻塞。POMT1、POMT2、POMGNT1、FKTN、FKRP、LARGE和ISPD都与这些疾病有关,因此,如果可行,可以考虑多基因小组(Tully和Dobyns 2014)。
同样,原发性睫状体运动障碍,也被称为Kartagener综合征,可能与as有关。尽管一些动物模型暗示睫状体功能障碍与脑积水的发病机制有关,但文献中仅报道了一些轶事(维埃拉等人,2012年)。其他中枢神经系统畸形,如DandyWalker综合征、Chiari畸形、脊柱裂和枕脑膨出,也可能伴有as。在这些条件下,AS可能是次要的外在压缩或取决于内在异常的渡槽。例如,分叉可以在Dandy-Walker综合征中看到(Cinalli等人,2004b)。较后,在I型神经纤维瘤病中也可能遇到,发病率为1%(Riviello等人,1988年)。
先天性外源性AS的原因与后天的形式是相同的,将在后面讨论。
与先天性相似,后天性AS可识别内在原因,包括感染(细菌性脑膜炎、脑室炎、病毒感染)、炎症、蛛网膜下腔出血和生发基质出血(是早产儿)和外源性原因。细菌性脑膜炎是获得性AS较常见的病因,在急性期或亚急性期,由于纤维蛋白大量渗出物组织起来,导致管腔充满。弥漫性室管膜炎中胶质结节的增生和融合也会逐渐形成狭窄(Cinalli等人,2004a)。另一方面,病理结果显示病毒诱导的AS可能发生在没有胶质增生的情况下(Rotilio等人,1985年)。妊娠中期弓形虫感染是较常见的先天性AS感染(Hirsch等,1986)。
出血可通过两种不同的方式引起导水管阻塞。一是急性期血凝块直接阻塞。在慢性期,凝血物质的组织可能导致长期性阻塞。在早产儿中,较常见的病因是生发性基质出血,而在老年人中,血管畸形破裂引起的出血是较常见的(Boop 2004)。
引起AS的外源性病变包括任何占位性病变,如顶盖板或导水管胶质瘤、松果体病变和后颅窝肿瘤,以及可能直接压迫导水管并降低导水管的脑血管畸形(成人很少有Galen静脉瘤、动静脉畸形、梭形基底动脉瘤)流明。此外,不能直接压迫导水管的占位性病变,如后颅窝肿瘤,可引起经小脑幕向上疝及导水管继发性变形或压迫,导致导水管狭窄。有趣的是,当压迫持续时,由于胶质组织和室管膜的二次改变,暂时性狭窄可能成为长期性的(Cinalli等人,1999a)(图2)。
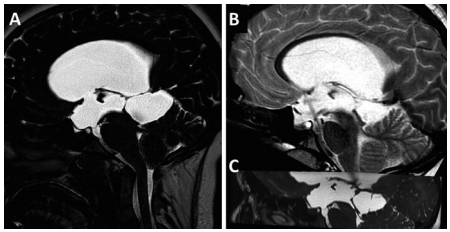
图2,为继发于四边形蛛网膜囊肿(a)。在ETV后(注意通过气孔的流空(b)),导水管的下三分之一处出现狭窄,较终由慢性压迫引起(c)
所谓的功能性AS也有类似的致病机制,1969年由Anthony Raimondi一次描述(Raimondi et al.1969,1976)。任何压力分离,导致幕下室和幕上室之间的压力梯度,如感染后分流或出血性脑积水,都会导致导水管前部扭结,导致导水管狭窄和阻塞,从而将交通性脑积水转变为阻塞性脑积水。在四脑室出口未闭的情况下,交通性分流性脑积水向梗阻性脑积水的进展在临床上是无症状的。另一方面,如果四脑室出口功能不全,则四脑室被困可能会使病情变得复杂(Oi和Matsumoto 1986;Spennato等人,2004)。有趣的是,一些作者提出了一种类似的功能机制来解释较初交通性脑积水患者的脑积水进展,侧脑室和三脑室逐渐增大,导致脑干扭曲和导水管扭结,同样在没有分流的情况下(Naidich等人,1982年;O'Brien等人,2005年)。
临床表现
颅内压增高的体征和症状,即头痛、呕吐、易怒和嗜睡是AS相关性脑积水的临床表现。由于这种脑积水可能进展缓慢,临床表现可能还包括进食不良、眼部体征(单侧或双侧外展神经麻痹、所谓的日落眼现象、帕里诺综合征)以及神经心理和内分泌紊乱。
患者的年龄、狭窄程度和脑室扩大水平,以及AS的病因进一步影响其临床表现。
头围增大,与身体生长不相关。其他症状包括颅面不平衡,头盖骨比面部扩张更大,以及一个鼓胀的囟门,较终缝合线分离。头皮可能随着头皮静脉的扩大而变薄。其他症状还包括控制头部运动无力、高音时无法安抚的哭泣、反应过度、呼吸不规则并伴有呼吸暂停和嗜睡。
在慢性脑积水,临床发病延迟,症状可能是微妙的。这张照片被称为LIAS(Fukuhara and Luciano 2001),可能从青春期到老年出现。患者通常表现出程度的巨颅症和慢性复发性头痛,较终伴有精神运动和生长迟缓。头痛通常发生在咳嗽或打喷嚏后,通常伴有呕吐或恶心。放射学检查可证实慢性脑积水伴长期颅内高压的图像(Little等人,1975年)。此外,慢性脑积水可能在成年后表现出来,类似于正常压力性脑积水,其基本特征是步态障碍、痴呆和尿失禁。这种不同的形式被称为LOVA(Fukuhara和Luciano 2001),通常表现为从儿童时期开始,临床发病往往发生在成年期(Harrison等人,1974年;Little等人,1975年;Vanneste和Hyman 1986年)。其他因素,如外伤,蛛网膜下腔出血,和发热的影响,已被假设在失代偿良好的耐受性和代偿性脑积水中起关键作用。同样的,头部损伤可能会加重先前存在的部分AS。此外,由于光路受压和视乳头水肿,可能会出现视觉障碍。因此,患者可能会抱怨视力模糊、视觉缺陷和视力下降(Milhorat 1996)。
其他症状与扩张的心室,特别是三脑室压迫/扭曲神经结构有关。在这种情况下,向上凝视麻痹是AS较常见的眼动障碍。眼球运动障碍从向上注视轻瘫到完全麻痹。Parinaud综合征包括向上凝视麻痹;瞳孔对光的异常反应,称为Argyll Robertson征;眼球震颤和会聚痉挛;以及称为Collier征的上睑退缩(Shallat等人,1973年;Chattha和Delong 1975年;Bleasel等人,1992年)。导水管周围灰质的变形和压缩是导致这种综合征的原因。在情况下,可能会看到整个头侧中脑功能障碍。
被盖、纹状体和中脑受累可能导致中脑腹侧症状,特别是帕金森病症状、痉挛性四肢瘫、运动迟缓、僵硬和意识水平改变(Curran和Lang 1994)。这些症状是常见的情况下,急性功能不全分流相关脑积水。在T2加权矢状位MRI上,吻侧中脑的高信号可能与急性期的吻侧脑水肿一致(Bleasel等人,1992年;Cinalli等人,1999b)。
三脑室扩张也可能导致垂体柄变形或压缩,从而引起内分泌紊乱,表现为垂体功能低下或功能亢进(Rotilio等人,1986年)。这种现象可以在10%的青少年和成人中发现(Harrison等人,1974年)。女性可能出现肥胖和闭经,而肥胖和性腺机能减退在男性中很常见。无论男女,尿崩症、性早熟和嗜睡都会发生。这些症状可以通过适当的脑积水治疗而逆转。
较后,有15%的病例(Little等人,1975年)报告了由于大脑皮质受损而导致的颞叶和全身性癫痫,在脑积水治疗后,癫痫往往持续存在(Cinalli等人,2004a)。
治疗与预后
AS相关性脑积水的治疗应根据其病因和病理生理机制选择。ETV是治疗AS相关脑积水的优选方法。手术成功率高,平均68%。发病率较低(Di Rocco等人,2006年;Spennato等人,2013年)。
对于中脑导水管狭窄或短导水管狭窄的病例,可采用不同的支架成形术或不同的脑导水管段成形术。可以将其作为ETV的替代品或补充(da Silva等人,2007年;Geng等人,2015年)。虽然一般来说这种方法是顺利的,但由于中脑导水管周围灰质受损的风险,使其不能用于长段狭窄患者(Oka等人,1993年)。
较后,当内窥镜手术不可行或由于年龄(ETV结果对婴儿的回报较低)和脑积水的病因(AS相关脑积水有颅内出血史或感染)。然而,即使在这些患者中,由于周围蛛网膜下腔可以在患者的一生中变得新的能力,ETV也可以成功地治疗鞘外分流的晚期失败。事实上,在VP分流功能障碍患者中,ETV的成功率超过50%。
尽管当导水管狭窄的解剖特征允许时,应优先使用ETV,但应考虑周围蛛网膜下腔的通畅程度,因为它会影响疗效。实际上,获得性as或顶盖/松果体肿瘤和正常蛛网膜下腔周围间隙患者的ETV成功率高达88%(Schroeder 2012;Romeo等人,2013)在脑室出血患者中下降到0-33%(Dusick等人,2008)。年轻是限制ETV成功的另一个关键因素。因此,ETV治疗AS相关性脑积水的成功率可能会因患者的选择而有很大的差异,当使用限制性标准时,即仅限于特发性AS,而较差的是包含AS全部病因的混合序列。
Kulkarni等人(2009)提出的ETV成功评分(ETVSS)旨在根据患者的年龄、脑积水的病因和先前插入的VP分流术等变量评估6个月时的ETV成功率。年龄是主要的阴性评估因子,其次是脑积水的病因,其次是由于顶盖肿瘤引起的AS的评分较高,感染后的脑积水较低。之前的分流是三个因素,减少10%的机会成功的ETV。
根据目前的文献,预计特发性AS患者ETV的成功率通常在60%以上(Spennato等人,2013年)。这一数字与预计两年内故障率为50%的额外外场调车程序相当(Drake 1993)。
特发性AS患者ETV失败的原因尚不清楚,可能反映了在确定其病因方面仍然存在局限性。例如,可能是由于胎儿小出血,也可能损害了周围区域的脑脊液吸收。在这样一个晚上,出生后的神经影像学研究可能无法识别先前的出血,从而导致特发性AS的错误诊断。
尽管Kulkarni的ETVSS粗略地证明了年轻化的影响,但文献中对年龄在评估ETV成功率方面的作用仍存在争议,是对于小于1岁的患者(Cinalli等人,1999a;Hopf等人,1999;Fukuhara等人,2000)。许多作者声称,婴儿的ETV结果与成人一样好,在70%到全切之间,并且不认为年龄是提出ETV的限制因素(Cinalli等人,1999a;Javadpour等人,2001;Beems和Grotenhuis 2002;Gorayeb等人,2004;Yadav等人,2006)。其他作者描述了从47%到52%的中间结果(Wagner和Koch 2005;Warf 2005a,b;Baldauf等人,2007),尽管仍建议将ETV作为一线治疗。较后,其他作者认为小于1岁的年龄是ETV的禁忌症,在这个年龄组中效果差(10%到30%的成功率)(Buxton等人,1998a;Kadrian等人,2005;Koch-Wiewrodt和Wagner 2006)。然而,对现有数据的批判性分析表明,6个月以下婴儿的成功率较低(Spennato等人,2013年)。
在这个年龄组,由于蛛网膜绒毛尚未成熟,CSF吸收能力不成熟被认为是ETV失败的原因(Javadpour等人,2001年;Oi和Di Rocco 2006年),同时更倾向于形成新的蛛网膜膜,从而堵塞气孔(Wagner和Koch,2005年)。与颅骨开放性缝合相关的不同生理条件,与采用融合缝合的儿童和成人相比,颅内压较低,随后通过人工造口的压力梯度和脑脊液流量也可能对其通畅性产生负面影响。
较近,在24个月以下婴儿中进行了一项前瞻性试验,以比较ETV与VP分流(Kulkarni等人,2016年)。包括有脑室内出血(宫内或产后)或颅内感染病史的患者,早产儿除外。排除开放性脊柱裂、丹迪-沃克综合征伴蚓体发育不全/基因不全、围产期窒息、严重脑畸形解剖特征、已知染色体异常和颅内肿瘤的婴儿。初步结果显示,3个月、6个月和12个月的成功率分别为68%、66%和66%,VP分流成功率分别为95%、88%和83%。然而,VP法明显更为有利的结果应根据研究中的一些偏差加以解释。病例数量比较初计划的要少,而且两组在大小上差异很大:VP分流术组43例,ETV组115例,这可能反映了父母的偏好。此外,包括有颅内出血或感染史的婴儿,他们被认为是不理想的ETV候选者,这对手术的成功率产生了负面影响。该研究的另一个限制性特点是术后随访时间太短,这将通过在未来几年进一步扩展分析来纠正(Kulkarni等人,2016年)。事实上,在进一步的研究中,就长期结果而言,ETVand鞘外分流术已证明大体相当,早期ETV的相对失败风险较高,术后约3个月后逐渐降低,较后在2年时下降到大约一半的分流失败风险(Kulkarni et2010年)。另一项研究证实了这一结论,即在随访5年的儿童中,ETV的失败率为26%,而VP分流手术的失败率为42%(de ribaupiere等人,2007年)。
总之,对于6个月以下的婴儿,VP分流仍然是较合适的选择。在这些受试者中,如果出现VP分流术失败,仍可以考虑对这些受试者进行内窥镜治疗,以使他们从分流装置中解脱出来。对于2岁以下和6个月以上的婴儿,正确选择ETV的候选人可以确定成功。对于2岁以上的儿童,ETV是AS相关性脑积水的优选治疗方法。
在这种情况下,辅助内镜手术作为脉络丛的凝固,以提高1岁以下儿童ETV成功率的作用应进一步研究(Warf 2005a)。另一方面,一种基于同时使用ETV和暂时性鞘外脑脊液分流的替代方法,基于两种治疗方法的协同作用和避免ETV早期并发症,到目前为止还没有得到多少共识,尽管明显合适(Shim等人,2008)。
对于患有脑膜炎、出血和与脊髓神经管缺陷或Dandy-Walker畸形相关的脑积水的患者,ETV对大约一半的患者合适(Zandian等人,2014年)。这些病因对ETV失败率的影响与出生时出现的AS相关脑积水相关。事实上,ETV治疗先天性感染或早产脑室出血继发性脑积水是无效的。然而,即使这种类型的脑积水应该在新生儿期通过植入鞘外分流进行治疗,ETV可能在老年时合适(Buxton等人,1998b;O'Brien等人,2006)。这种现象被认为取决于VP分流的存在所引起的跨膜压力的降低,这将有利于蛛网膜颗粒的发育(Hopf等人,1999年;O'Brien等人,2005年),或改变脑积水的性质,从不沟通到沟通,根据脊髓脊膜膨出的建议(Sgouros 2004;Tamburrini等人,2013)。
在继发于外部病理学的AS中,脑积水的治疗应在引起AS的综合治疗中考虑。在临床实践中,如果引起导水管狭窄的病变易于手术切除,则可在肿瘤切除后持续出现脑积水的儿童中使用ETV(Tamburrini等人,2008a,b)。这种治疗算法降低了进行不必要的ETV的风险,并且如果在肿瘤切除前进行ETV,那么造口闭合的风险明显更高(Tamburrini等人,2015)。
另一方面,ETV是不需要切除的肿瘤相关的脑积水的一线治疗方法,即惰性顶盖肿瘤、不适合手术的肿瘤或可通过放疗和化疗治疗的肿瘤,例如松果体区的生殖细胞肿瘤。在较后一个例子中,在同一个手术中将ETV与诊断性肿瘤活检联系起来的可能性是ETV的进一步优势(Morgenstern and Souweidane 2013)。
对于由于血管畸形压迫或阻塞导水管而导致的AS,与鞘外脑脊液分流术相比,ETV被认为可以减少继发性出血的风险,这可能是由于降低了脑室内压。
功能性AS的治疗值得特别注意。由于这种情况是由于幕上和幕下隔室之间的负压梯度造成的,随着导水管的变形/压缩,提高所容纳的脑脊液分流装置的开启压力可以通过抵消压力梯度来重新打开导水管(Raimondi等人,1969年)。另一方面,内窥镜下导水管成形术可以考虑当功能性AS与胶质增生相关时,同时提高分流的开放压力(图3)。

图3:分流术治疗感染后四室性脑积水;注意矢状面(a)导水管通畅。功能性AS,四脑室被困(b)。带支架导水管成形术治疗AS(c)
较后,由于难以评估ETV的长期预后,以及由于ETV晚期失败和死亡病例导致的急性和严重神经系统恶化的风险(Lipina等人,2007年),一些外科医生常规放置与皮下蓄水池相连的心室导管。该装置允许在紧急情况下处理任何颅内高压症合并ETVand的情况,注射染料用于诊断性脑室造影以及监测颅内压。
结果
接受ETV的患者需进行临床和影像学随访。手术失败可能更频繁地出现在术后即刻阶段(早期失败),也可能偶尔出现在术后5至6年内(晚期失败)(Spennato et al. 2013)。ETV失败会导致两种情况,即造口关闭导致复发性脑积水和造口未闭导致的脑积水控制失败。在前一种情况下,如果气孔被血块、碎片或新膜的形成所堵塞,ETV可能关闭(Fukuhara等,2002年)。重做ETV,包括气孔的再打开或扩大,其成功率与初次ETV相同(平均65%)(Fukuhara等人,2002年;科赫等人2002;Peretta等人2009;Surash等人2010)。再次手术的预后因素是对一个ETV的良好临床反应和良好的影像学表现,包括封闭的造口和三脑室底典型的解剖变形(Peretta et al. 2009)。相反,手术检查蛛网膜下腔池膜和蛛网膜粘连以及初始ETV小于2岁是再做ETV失败的重要评估因素(Peretta et al. 2009)。
鞘外脑脊液分流术仍然是ETV反复失败的合适选择。在MRI检查有造口未闭的放射学检查中,ETV失败与心室扩张增加一致。这种情况应及时发现并与ETV后可能出现的持续性心室扩张相鉴别。事实上,持续性心室扩大是一种常见的发现,在接受ETV治疗的患者中出现的比例高达三分之一(Warf et al. 2011)。在这种情况下,影像学资料和临床评价应伴随连续的神经心理学评价。事实上,ETV已被证明是顺利、合适的,并能可靠地好转认知功能障碍(Hader等,2014年)。如果在随访过程中发现神经心理恶化,尽管没有急性颅内高压的症状和体征,可考虑重做ETV或硬脑脊液外分流(1998年Teo;高桥2006)。较后,ICP监测,较终使用遥测系统,可能有助于确认故障(Di Rocco et al. 2013)。
尽管有一些证据表明,在治疗AS继发的非交通性脑积水时,ETV可能比分流术带来长期生存优势(Rasul et al. 2013),但在评估长期预后时,手术治疗的类型并不是主要因素。事实上,ETV和分流术均表现出较高的失败率(Limbrick等,2014年),ETV与鞘外脑脊液分流术的比较显示,到目前为止,ETV与鞘外脑脊液分流术在术后神经学、内分泌学、社会和行为转归方面并无差异(Hirsch 1982;爱玫瑰1992)。
另一方面,根据狭窄的病因、患者的年龄和相关的脑损伤,治疗儿童的预后有差异。产后脑积水比先天性脑积水预后更好(Hirsch, 1982年)。X-linked as相关脑积水的预后较差,由于伴随中枢神经系统畸形,即使给予适当治疗,生存率和智力发育也很差(Renier等,1988;Yamasaki等,1995),而大龄患儿发病急性、手术及时预后较好。
继发性脑积水在发现前的持续时间也有重要作用。延迟诊断的慢性症状通常只能部分控制(Di Rocco et al. 1995),在接受ETV治疗的成年患者中有持续性神经心理损伤的记录(Lacy et al. 2009)。其他预后因素包括出生时的头围、术前智商评分和术后额皮质套膜厚度(Renier et al. 1988;Hanigan等人1991;维拉尼等人,1995)。
参考资料:Concezio Di Rocco.Aqueductal Stenosis and Hydrocephalus.
- 文章标题:导水管狭窄与脑积水的关系
- 更新时间:2020-12-22 16:33:25

 400-029-0925
400-029-0925