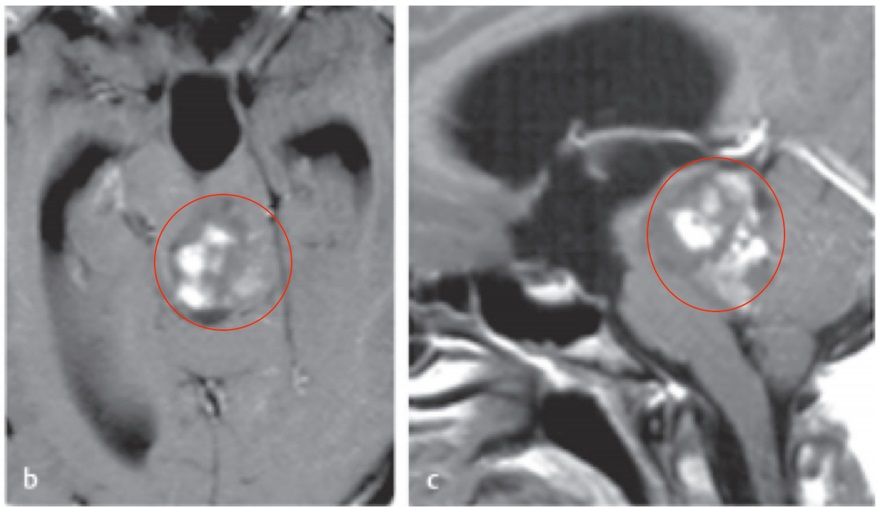
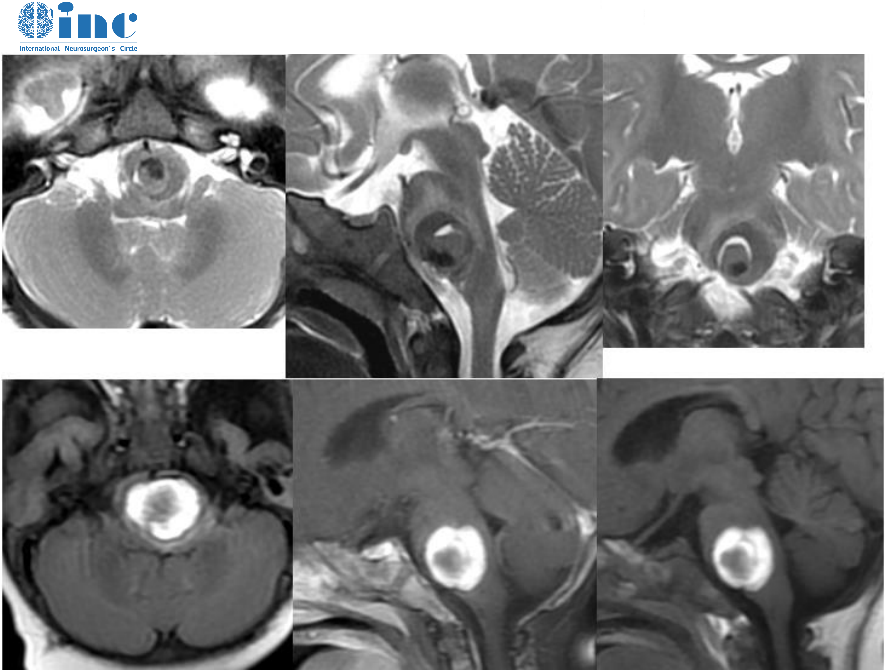
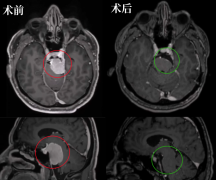
低级别胶质瘤分为二级,通常生长缓慢,渗透性的肿瘤呈现通常在二人生的四个十年。这些可以确定顺便成像或无症状的患者可能会出现广泛的症状取决于肿瘤的位置。症状包括癫痫发作、头痛、性格改变、认知障碍、局部虚弱或语言障碍。目前,国际各地的治疗中心差异很大,很大水平上是因为系统证据仍然有限。该领域的随机对照试验是具有挑战性的,因为肿瘤的少见性质,缓慢的生长和可变的结果。

治疗的主要方式是手术切除。在大多数“低风险”情况下,临床改变和进展的观察通常被认为是较年轻(<40岁),而病灶相对较小的无症状患者有越来越多的数据表明,早期切除可能更顺利,并可能好转全部患者的长期生存结果。在全切除或次全切除后,观察与放疗和/或化疗治疗的问题再次出现。在这方面,实践和建议也有很大的不同。确实有证据表明患者(>40或大部切除)在无进展生存期(PFS)和总生存期(OS)方面受益于放疗和化疗。化疗的类型因中心而异[替莫唑胺与三种药物方案普鲁卡因、洛莫司汀和长春新碱(PCV)]。在其他中心,考虑到辐射的长期影响(是可能多次复发的年轻患者),辐射可以延迟,患者可以单独开始化疗。因此,LGG的管理是一个复杂的,有争议的领域,许多方面增加了对这一患者群体的评估困难。
生存和预后
LGG患者的生存时间一般在3 - 15年之间,但这可能是可变的,取决于过去几十年研究的各种因素。在大多数随机研究中,5年总生存率为58 - 72%。年龄较大——至少40岁或以上——如上文所述,预示着疾病进展的更,并将患者纳入应自动考虑切除或治疗的类别。在大量的分析中,其他同样显示出进展的“较”和较差结果的因素包括星形细胞瘤种(而不是少突胶质细胞类型)、肿瘤大小>6 cm、跨越中线的肿瘤和手术前的神经功能缺损。增加的预后因素与较短的中位总生存率(OS)(例如,3.2年3-5个因素)相关。较小的研究已经证明了一些其他肿瘤特异性因素的重要性,这些因素应该与更正式的预后评分一起考虑。造影增强的存在和随着时间的快速变化与较差的结果有关。多病或神经功能障碍导致的较差的功能状态也预示着较差的预后,认知功能障碍也是如此。值得注意的是,在诊断时癫痫发作实际上预示着更好的预后和更长的生存期——这已在许多研究中被发现。较近的数据也研究了种族和民族对生存率的影响,发现发病率和生存率因种族而异。与西班牙裔白人、黑人、人和太平洋岛屿居民相比,非西班牙裔白人的胶质瘤发病率较高,而他们的生存率较低。这适用于全部类型的胶质瘤,无论是低级别还是高级别。
分子特征与LGG的预后和生存有关,并且越来越多地被理解为胜过其他预后特征。较值得注意的是,异柠檬酸脱氢酶(IDH)突变已被发现与LGG的阳性预后相关,也提示对替莫唑胺有更高的反应率。这同样适用于1p19q编码缺失——这一共缺失的存在导致了少突胶质细胞瘤的诊断,预示着总体阳性(PFS)和OS。即使考虑了其他因素,如肿瘤分级、患者年龄、大小等,单独的共缺失也是延长生存的评估因素。与单独IDH突变48个月和IDH野生型组20个月相比,同时具有IDH突变和1p19q共缺失的LGG联合可导致62个月的中位无进展生存期。较近有研究表明,CDNK2A、CDK4和染色体14的改变等其他分子特征在评估预后方面也比主观肿瘤分级更可靠。
α地中海贫血/智力低下综合征(ATRX)基因和端粒酶逆转录酶启动子的额外突变也是关键,而且随着人们对它们的了解,它们也越来越突出。TERT参与端粒酶编码,ATRX在端粒维持中起着重要作用,两者的突变在胶质瘤中是相互排斥的。在低级别胶质瘤中,当发生1p19q共排和IDH突变时,TERT突变可成为一个阳性预后因子。IDH突变星形细胞瘤(无1p19q共排)中ATRX的丢失是一个的预后因素,与PFS和OS好转相关。
因此,可以从这一证据中综合得出,PFS和OS的预后不利因素可归因于年龄较大(>40),症状严重的患者,大型肿瘤(>5 cm)星形细胞瘤,IDH野生型,横穿中线,无法轻易切除。我们认识到,这个不同的病人可能会有不良的结果,特别是如果他们在偏瘫或癫痫手术前已经做得很差,或者在初次切除后不久进展。我们也知道,高危患者在进展中应该得到更快的治疗,治疗有助于他们的PFS和OS,但是他们得到的治疗是可变的,如上文所述。然而,更具挑战性和更难评估的病例是那些不属于“较坏预后”类别的患者,或者预后“好”或“混合”的患者。例如,年轻的少突胶质瘤患者,肿瘤很大,症状严重,或是一位年龄较大的患者,在功能区内有小型星形细胞瘤,引起症状。这些患者,在临床上更典型的人群,没有遵循研究中确定的路径,他们的旅程更难评估。此外,上述数据一般只能应用于前期设置的病例,不能轻易地转换为复发或前切除后或放疗和化疗后进展的病例。
- 文章标题:低级别胶质瘤预后如何?
- 更新时间:2021-06-09 11:47:04

 400-029-0925
400-029-0925