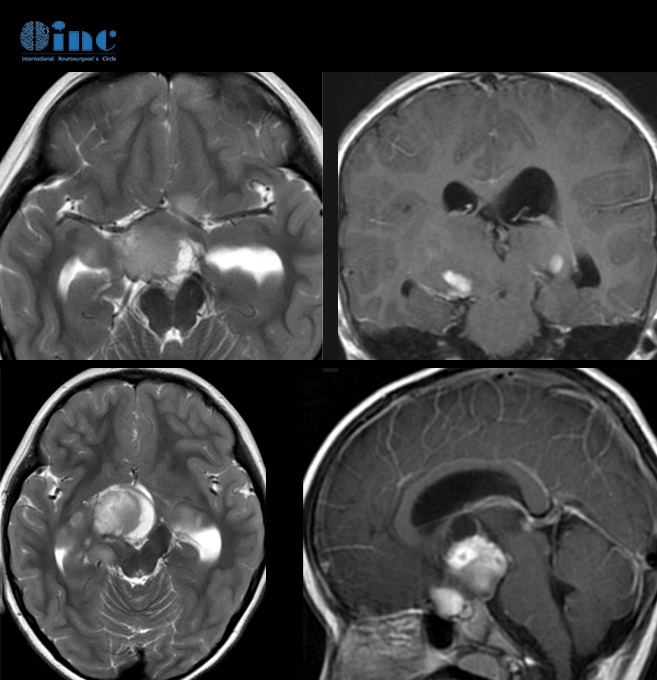
高级别胶质瘤是什么?胶质瘤是成人较为常见的原发性脑肿瘤,高级别胶质(high-grade glioma,HGG)恶性程度高,预后不良。根据2016版WHO中枢神经系统肿瘤分类报告,高级别胶质瘤包括间变性星形细胞瘤(Ⅲ级)、间变性少突胶质细胞瘤(Ⅲ级)、胶质母细胞瘤(glioblastoma,GBM;Ⅳ级)和伴H3-K27M突变的弥漫性中线胶质瘤(Ⅳ级)。
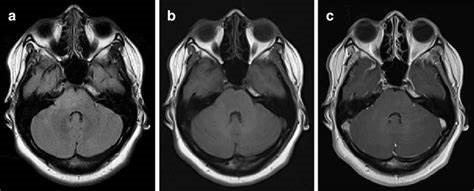
高级别胶质瘤怎么治疗?目前,手术仍然是高级别胶质瘤治疗的基础,神经导航系统(neuronavigation system,NNS)和术中荧光引导等技术可帮助更好地辨识肿瘤边界和重要神经。其中,胶质母细胞瘤GBM的标准术后辅助治疗是联合替莫唑胺(temozolomide,TMZ)的放、化疗,明显好转胶质母细胞瘤GBM的生存预后。但高级别胶质瘤即使接受的综合治疗,预后也较差,胶质母细胞瘤中位生存期(median survival time,MST)仅14.6个月。
高级别胶质瘤的手术治疗
手术是高级别胶质瘤治疗的基础,不仅能解除肿瘤的占位效应,还能取得肿瘤组织行分子病理诊断,为进一步的治疗提供依据。肿瘤切除程度与病人预后密切相关,提高肿瘤切除程度,可明显好转病人预后。然而,随着手术观念的改变,逐渐意识到过于激进的手术切除会引起的神经系统并发症,是涉及言语、运动等重要功能区域的手术。为较大水平切除肿瘤并保留重要神经功能,可借助一些前沿的辅助技术辨别肿瘤组织与正常组织的界限,对重要的脑功能区域和神经结构进行定位。这些手术辅助技术包括功能磁共振成像、术中NNS、术中荧光引导技术、术中超声等。
高级别胶质瘤的放疗
术后早期放疗对高级别胶质瘤重要,一般认为手术与放疗的等待时间在6 周以内是可以接受的。放疗的标准基于CT和MRI的影像学表现以及肿瘤的组织学特征。放射治疗肿瘤学组和欧洲癌症治疗组织关于高级别胶质瘤放疗的建议是以局部照射为主,靶区应参考术前MRI范围和术后脑组织移位情况。高级别胶质瘤周围常常有水肿区,实际放疗时会根据肿瘤生长走行、病理类型等进行靶区外扩,不过中线的胶质瘤一般不进行对侧的照射。
放疗采用常规分割的X 线外照射,总剂量通常不超过60 Gy,但辅助TMZ治疗时,放射剂量增至75 Gy,未发现明显的中枢神经系统毒性,但中位生存期略有好转。HGG术后仅接受放疗的生存获益并不理想,而联合TMZ化疗明显好转放疗的效果。BGM术后标准治疗是放疗联合TMZ化疗;一阶段持续6周,放疗剂量为60 Gy,TMZ剂量为75 mg/m2/d;二阶段TMZ剂量增至150~200 mg/m2/d,连续5 d,28 d一个疗程,持续6个周期。
高级别胶质瘤的化疗
对于高级别脑胶质瘤,由于其生长及复发迅速,进行合适的个体化化疗会更有价值。
Stupp方案:在放疗期间口服TMZ75mg/(m2 ·d),连服 42d;间隔 4 周,进入 辅助化疗阶段,口服TMZ 150~200mg/(m2 ·d),连用 5d,每 28d 重 复,共用 6个周期。
PCV方案:甲基苄肼(PCB)60mg/(m2 ·d),d8~21;洛莫司汀(CCNU) 110mg/(m2 ·d),d1;长春新碱(VCR) 1.4mg/m2 ,d8、d29。8 周为 一周期。
可以选择的其他化疗药物还有卡莫司汀、伊立替康、依托泊苷、顺铂、卡铂、环磷酰胺等。
近几年,研究和临床试验更进一步发展,神经外科医生在临床咨询时有了更多的治疗手段可供选择,患者也很大水平上缓解了病痛,拥有了更高的生存质量。攻克“死亡恶魔”脑胶质瘤,国际神经外科领域时常会有各种新技术、新药物、新理念、新疗法在诞生,脑胶质瘤特别是胶质母细胞瘤、儿童脑干弥漫内生型桥脑胶质瘤(DIPG)等高级别恶性胶质瘤的生存率将继续提高,更大的长期生存希望、更光明的未来是指日可待的。
- 文章标题:高级别胶质瘤是什么?有什么治疗选择?
- 更新时间:2021-08-10 10:09:40

 400-029-0925
400-029-0925