BRAF V600E突变参与了约10%-20%的小儿胶质瘤和一小部分成人HGGs的病理发生过程。多数儿童低级别胶质瘤中有BRAF基因的异常突变,包括点突变、融合突变。BRAF V600E点突变可出现于大部分儿童低级别胶质瘤的病理学亚型,发生率约17%,是小儿低级别胶质瘤中常见的点突变基因。
研究发现,在儿童低级别胶质瘤中,BRAF V600E突变与预后密切相关:BRAF V600E突变的患儿中,全切者与未全切者5年的无进展生存率分别为67.8%、38.8%,而BRAF野生型患者这一比率分别为95.9%、53.3%,这提示BRAF V600E突变是儿童低级别胶质瘤预后不良的标志;儿童低级别胶质瘤很少向高级别胶质瘤进展,这点与成人不同(成人50%-60%以上较终进展为高级别胶质瘤),但具有BRAF V600E突变的儿童低级别胶质瘤转化风险明显高于野生型患儿,且对术后化疗的反应较。综上所述,在儿童低级别胶质瘤中,BRAF V600E突变(往往合并CDKN2A突变,)可能作为重要的分层指标,代表一种独自类型的儿童低级别胶质瘤,提示预后相对较差。
2020年5月,由INC国际神经外科顾问团成员、国际神经外科杂志《Journal of Neurosurgery》主编、加拿大多伦多大学儿童医院脑瘤研究中心主席James T.Rutka教授参与研究的一个BRAF V600E突变小儿胶质瘤项目中,采集研究了来自多个国家的29个中心的BRAF控制治疗的BRAF V600E突变型神经胶质瘤患者的临床、影像学、分子和结果信息。
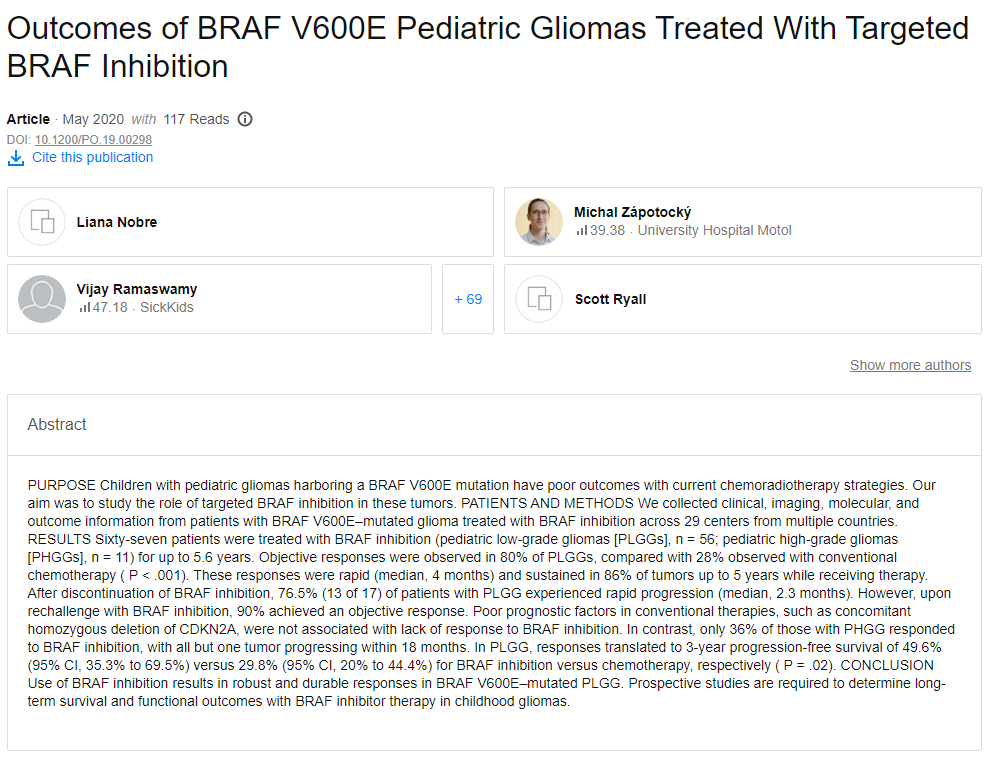
该研究结果标明,67例患者接受了BRAF控制治疗(小儿低度神经胶质瘤[PLGGs],n=56;小儿高度神经胶质瘤[PHGGs],n=11),治疗时间长达5.6年。在80%的PLGG中观察到客观反应,而在常规化疗中观察到28%(P<001)。这些反应迅速(中位数为4个月),并在接受治疗的情况下在86%的肿瘤中持续长达5年。
停用BRAF控制后,76.5%(17中的13)的PLGG患者经历了快速进展(中位数为2.3个月)。然而,在用BRAF控制再治疗后,90%达到了客观反应。
传统疗法中不良的预后因素,例如伴随的CDKN2A纯合缺失,与缺乏对BRAF控制的反应无关。相反,只有36%的PHGG患者对BRAF控制有反应,除一种肿瘤外,其他全部肿瘤均在18个月内进展。在PLGG中,BRAF控制相对于化疗的3年无进展生存率分别为49.6%(95%CI,35.3%至69.5%)和29.8%(95%CI,20%至44.4%)(P=.02)。这标明了使用BRAF控制可在BRAF V600E突变的PLGG中产生强大而持久的效应。
据悉,James T.Rutka教授是多伦多儿童医院神经外科教授、国际神经外科学院前院长,而且曾被评为加拿大更佳医生。而且他领衔的SickKids脑瘤研究实验室在研究脑肿瘤生长和侵袭的机制方面颇有成就,在脑肿瘤的靶向治疗研究上取得了多项进展。他所在的加拿大多伦多儿童医院有着接近150年的历史,是加拿大六大自立儿童医院之一,也是国际上儿童医院,特别是在儿童肿瘤治疗上,有着其独特的研究和前沿性,在许多肿瘤前沿疗法上,都走在国际前沿。

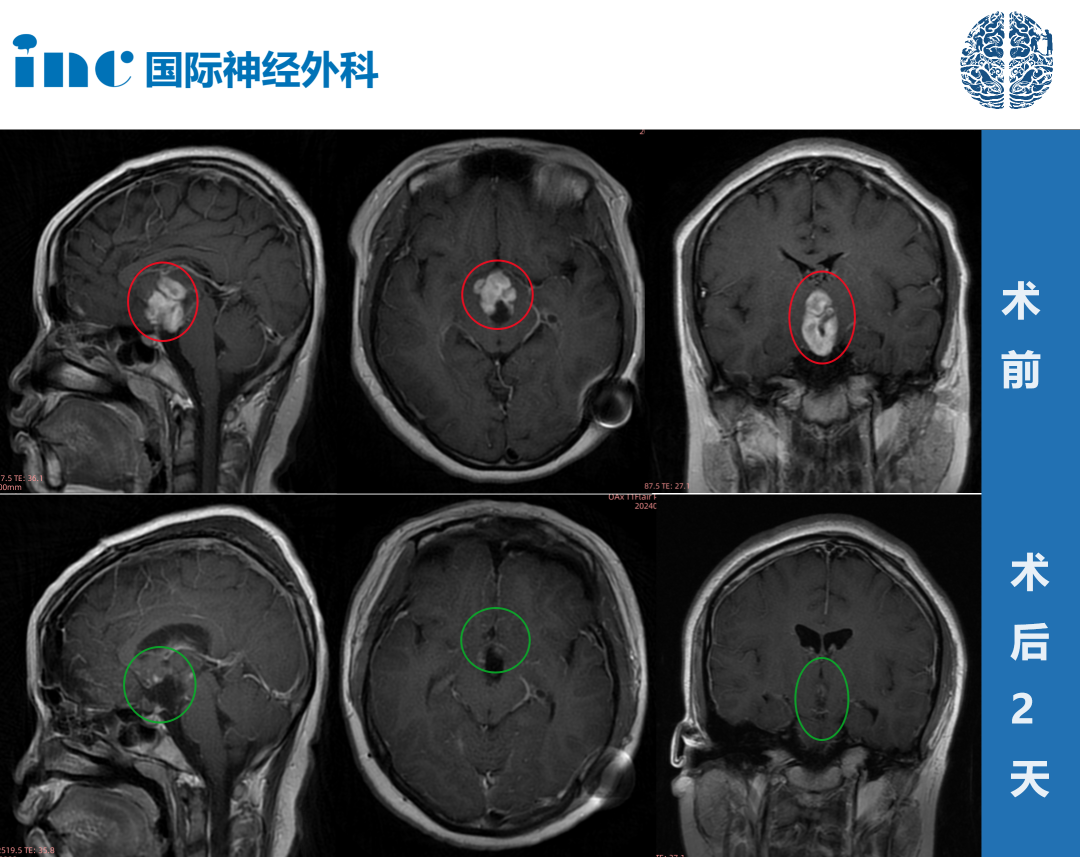
对于小儿低级别胶质瘤的治疗,Rutka教授还提示,处于表浅或非功能区位置的低级别胶质瘤的优选治疗是手术全切肿瘤。在多数情况下,即使病变位于脑干或丘脑等难以手术的位置,也可通过手术切除合适治疗。借助功能性MRI和脑磁图检查、微神经外科手术技术、术中神经监测和影像学功能性脑图谱,可以切除先前无法手术的肿瘤,同时将手术发病率降至较低。
化疗在治疗神经外科手术具有很大挑战时的低级别神经胶质瘤中的主要作用是延迟放射治疗或其他治疗,特别是对于幼儿。文献中的大多数研究都集中在视神经或下丘脑的低级别神经胶质瘤上。在这种情况下,化疗可以产生的反应或稳定的影响,而无需使孩子遭受手术或放射疗法的神经系统后遗症。通常,当没有进一步的神经外科手术选择时,或者对于足够大以接受放射治疗的孩子(通常年龄大于5.11岁)进行化学治疗失败时,应使用放射治疗。
- 文章标题:治疗小儿BRAF V600E突变胶质瘤,靶向BRAF控制发挥的作用
- 更新时间:2020-06-15 10:28:39

 400-029-0925
400-029-0925