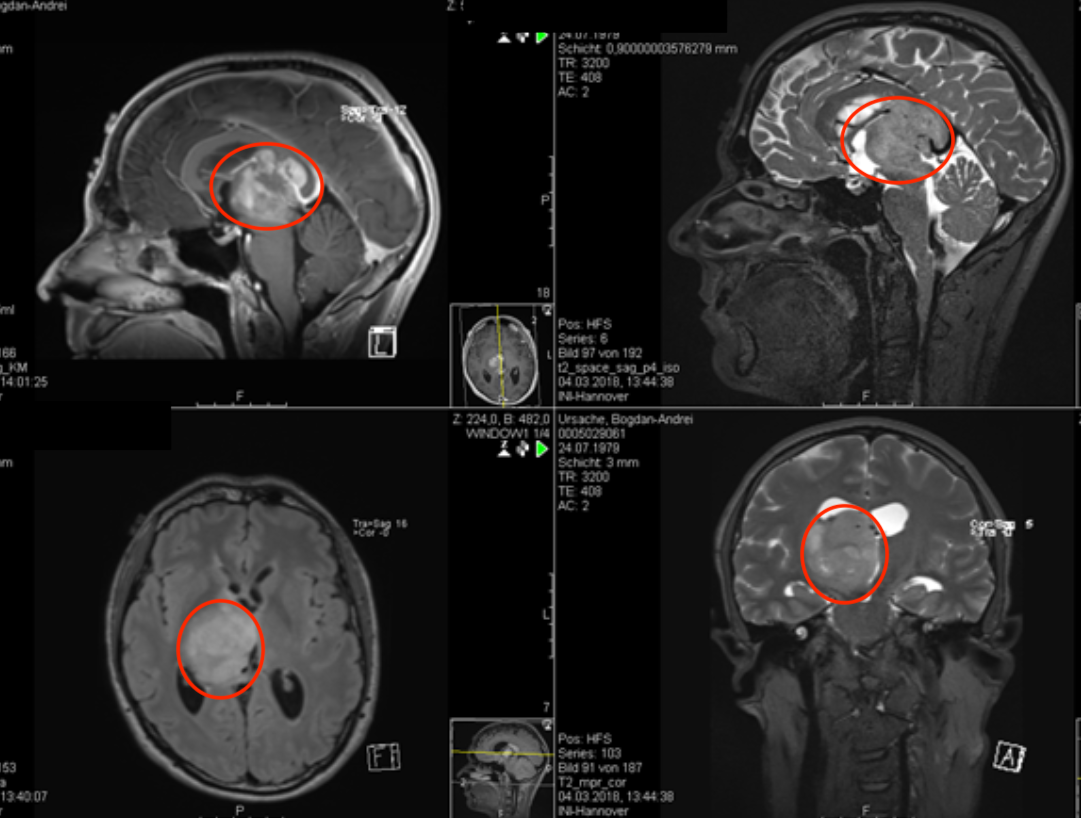
神经胶质瘤是人类中较致命的实体瘤之一。去年,美国癌症协会将这种疾病归因于估计有17,600例脑肿瘤新病例和13,200多例死亡。患者的预后不佳,中位生存时间从6个月到5年不等,具体取决于肿瘤的等级。脑肿瘤的手术切除受到可及性(即可能发生神经系统损害的风险)和肿瘤可切除性的限制。当前的标准治疗包括外科手术和放射线的结合。正常的脑组织不能接受辐射的限制,因此这种方式的使用受到其对正常组织的毒性的限制。较终,治疗由于肿瘤细胞的抗性而失败。

关于巴罗神经学研究所
在美国的众多医院中,坐落于美国凤凰城的圣约瑟夫医疗和医学中心的巴罗神经学研究所(Barrow Neurological Institute,简称BNI)是国际规模较大的神经科学诊断、治疗和研究中心之一。
美国巴罗神经研究所一直致力于研究脑神经脑科类疾病,它是国际上脑血管动脉瘤、下丘脑错构瘤和其他脑肿瘤、帕金森氏病以及复杂脊柱疾病治疗的,也是美国神经科学教育、培训、研究和患者护理的领导者和运动障碍的神经外科治疗领导者。美国巴罗神经研究所拥有11个国际前沿的神经外科手术室, 可进行3T术中磁共振,是美国较繁忙的神经外科手术中心之一,也是美国穆罕默德阿里帕金森中心的所在地。
对于脑胶质瘤、脑膜瘤、听神经瘤、松果体肿瘤、室管膜瘤等脑肿瘤疾病,巴罗有多种前沿的技术手段可以解决,包括微创脑外科手术、激光热消融手术、ZAP-X放射外科技术、立体定向放射治疗、近距离放射治疗、术中刺激映射等。巴罗的神经外科医生每年进行1300多次脑肿瘤手术,比美国其他任何大学或医疗中心都要多。此外,巴罗还是国际上一个也是一个提供ZAP-X技术平台的中心,这是使用放射外科技术进行非侵入性脑肿瘤治疗的较新创新。
恶性脑肿瘤的治疗还包括用亚硝基脲[1,3-双-(2-氯乙基)-1-亚硝基脲(BCNU)或洛莫司汀(CCNU)]单药化疗,以及与其他药物联合化疗。但是,这些措施在超过95%的病例中局部失败。脑肿瘤的靶向治疗由于血脑屏障的通透性限制而变得复杂,几乎全部的脑癌治疗均因正常肿瘤复发而受挫。脑组织。因此,针对肿瘤细胞增殖的当前治疗方式在阻止这种疾病的进展方面显示出有限的成功。全部神经胶质瘤在治疗后都会复发,通常在原发肿瘤部位的2至3 cm之内。与大多数其他实体瘤不同,神经胶质瘤几乎从未建立全身性转移。局部侵袭性胶质瘤细胞投资到脑实质成为损害的种子的患者。针对诸如神经胶质瘤的局部疾病的治疗策略的发展较有可能带来患者临床结果的深刻好转。因此,对局部脑部侵袭的生物学进行清醒的思考以及开发这种行为的可能方法对于开发针对这种疾病的新疗法至关重要。
胶质瘤为何恶性程度如此之高
越来越多的证据提供了强有力的推论,可以得出结论,随着特定遗传畸变的积累(可能是抑癌基因的丧失和致癌基因突变的出现),肿瘤细胞的行为会下降为恶性程度。这些分子遗传学研究从切除的肿瘤病变中获得了它们的信息。即使在它们的边缘,这些标本也是典型的大块,拥挤的肿瘤块。
同一级别的不同神经胶质瘤之间以及单个神经胶质瘤样本中的异质性程度显着。但是,关于神经胶质瘤分子变化的调查尚缺乏侵袭性神经胶质瘤细胞的基因型,只有当其长成实体复发性肿瘤时才成为研究的主题。然而,从形态学上来看,有明确的证据表明,引起复发的侵袭性细胞可能是肿瘤周围边缘以外的小间变性胶质瘤细胞。
胶质瘤侵袭是影响胶质瘤细胞多种特征的动态过程。在任何给定的时期内,例如在活检时,神经胶质瘤细胞的侵袭和增殖行为在区域和时间上都是可变的。单看活检分析未能证明增殖与侵袭之间的关联可能并不奇怪。尽管远处侵袭性神经胶质瘤细胞的增生指数低,甚至无法识别形态学上距肿瘤边缘4厘米以上的神经胶质瘤细胞,但仍可以在这样的距离上收获克隆性神经胶质瘤细胞。这些侵入性较高的神经胶质瘤细胞的克隆形成潜力,被皮尔金顿(Pilkington)称为“游击细胞”,是肿瘤复发的较终原因。侵袭性神经胶质瘤细胞如何在侵袭,如何避免免疫检测, 阻止细胞毒性疗法和延缓对增殖的承诺的条件下生存,在 很大水平上尚不清楚。然而,近来,神经胶质细胞侵袭的生物学,无论是处于发育状态还是处于患病状态,都得到了发展,这使得组装迁移神经胶质细胞的功能性约束范式得以实现。
正常星形胶质细胞的侵袭
在发育上,成胶质细胞以O-2A祖细胞(2型星形胶质细胞)或1型星形胶质细胞出现在脑室下区域。神经胶质向心扩散到皮质,伴随着由层粘连蛋白,腱生蛋白和玻连蛋白以及蛋白聚糖组成的定向基质纤维的加工,这些蛋白促进了后代神经胶质细胞的运动。
胶质细胞在发育过程中的运动性是与其基质接触以及通过特定受体介导的动态细胞间相互作用的表现。星形胶质细胞上的间隙连接蛋白,连接蛋白,在神经胶质细胞的行为,包括通讯途径和细胞增殖中,表现出明显的作用。缺乏表达连接蛋白的能力的敲除小鼠会发育成活的后代,但它们的大脑显示出与异常星形胶质细胞迁移一致的结构异常。连接蛋白的磷酸化状态可能调节细胞间的交流;胶质细胞的癌基因转染导致连接蛋白的磷酸化降低。
与相邻细胞上的NCAM结合的神经细胞粘附分子(NCAM)促进星形胶质细胞迁移。在发育过程中,星形胶质细胞上NCAM的水平显着降低 ,对星形胶质细胞的运动性和支持神经突生长的能力都有影响。
像许多生长因子一样,可溶性因子实际上是星形胶质细胞迁移的合适激活剂。转化生长因子b,碱性成纤维细胞生长因子,表皮生长因子和转化生长因子a均促进星形胶质细胞迁移。较早的神经胶质细胞,放射状胶质细胞,在胚胎大脑精心设计的可溶性因子的影响下,保持其未成熟的迁移状态。当暴露于这些相同的因素成熟星形胶质细胞采用放射状胶质细胞形态。
尽管术语神经胶质细胞将这些细胞的早期解剖学描述称为一种大脑“胶水”,但成年星形胶质细胞保留了其迁移的能力。在创伤,中风或其他以坏死性脑细胞为特征的疾病之后,星形胶质细胞迁移并增殖形成疤痕组织。当在细胞培养物中繁殖时,从正常大脑分离的未转化的星形胶质细胞具有成功的迁移行为,并且自我更新的能力有限。在脑肿瘤的情况下,神经胶质瘢痕形成很常见。当适当激活时,正常星形胶质细胞对大脑的这种细胞重塑表明侵袭是星形胶质细胞的正常且受调节的行为。
将大脑组织或脑细胞培养物移植到发育中或成年大脑中的研究也突出了星形胶质细胞对运动的倾向。这种植入的星形胶质细胞的迁移在白质束中总是较明显的。年轻的发育不成熟的大脑通过移植的星形胶质细胞维持广泛的浸润,与成熟大脑的可塑性丧失相一致。以互补的方式,如果诱导未成熟的神经胶质细胞在体外分化,那么它们作为颅内移植物的侵袭潜力也会降低。这些发现表明,星形胶质细胞的分化伴随着迁移潜能的降低,而完全成熟的大脑是一种对细胞渗透具有抵抗力的结构。特定整联蛋白基质受体的激素诱导可以使成熟星形胶质细胞在特定底物上的迁移行为重新参与,这表明具有通过完全分化的细胞回忆发育程序的能力。
由于其非转移性质,因此神经胶质瘤是发展局部疗法的理想癌症。胶质瘤传播的自然模式表明,白质是胶质瘤细胞入侵的优选途径。鉴于人们对细胞与周围环境的相互作用生物学有了更深入的了解,因此出现了一种细胞与底物相互作用如何影响许多细胞行为的范例。
胶质瘤侵袭生物学
胶质瘤细胞与其细胞和细胞外基质(ECM)环境之间的相互作用是由粘附分子(一种细胞表面受体家族)介导的。粘附分子的表达是器官特异性的,这可能解释了某些器官中肿瘤的优先播种。与大多数通过淋巴和血管系统转移到远处器官的肿瘤不同,这也可以解释为什么恶性神经胶质瘤几乎远远不会在脑外播种。粘附分子根据其功能行为进行分类,该功能行为源自其氨基酸序列和受体配体。细胞粘附分子的四个主要类别是整联蛋白,钙黏着蛋白,选择蛋白和免疫球蛋白超家族。
整联蛋白是跨膜糖蛋白,其充当ECM蛋白中发现的特定氨基酸序列或其他细胞上的膜结合反受体的受体。由于ECM在整个组织中无处不在,因此整联蛋白既可以建立实体组织的质地,又可以介导正常细胞和转化细胞的许多运动行为。肿瘤细胞系显示整联蛋白的表达和/或功能改变。例如,在乳腺癌中,整联蛋白a3b1和a3b3在神经胶质瘤细胞系中过表达,而a2b1和a6b4则在乳腺癌中下调。整联蛋白表达可能与肿瘤进展有关。avb3在正常皮肤黑素细胞中不存在,但在黑素瘤中强烈表达。
中枢神经系统总体积的约20%由细胞外空间组成,大部分由构成ECM的复杂大分子填充。54基质中的分子,包括纤连蛋白,胶原蛋白和蛋白聚糖等,会影响细胞功能的数量,包括粘附,迁移,增殖和分化。胶质瘤细胞的迁移取决于基质中的配体。层粘连蛋白和IV型胶原是星形细胞瘤迁移的许可底物,而纤连蛋白和玻连蛋白几乎是不允许的。
胶质瘤细胞之间的相互作用,其ECM和整联蛋白的表达已被广泛分析,全部与细胞的迁移能力有关。单个细胞可以通过整合素的选择性表达来改变其粘附特性。细胞还可以调节整联蛋白的结合特性。正常的星形胶质细胞表达整联蛋白亚基a2,a3,a6,b1和b4,而亚基a4,a5,av,b2和b3始终不存在。相反,赘生性星形胶质细胞显示这些亚基的表达和/或新表达增加。
Ohnishi等表明,纤连蛋白可以刺激神经胶质瘤细胞的迁移。a5整联蛋白亚基的表达程度与神经胶质瘤细胞对纤连蛋白的粘附强度密切相关。使用原发性肿瘤细胞的研究表明,神经胶质瘤细胞对纤连蛋白的粘附强度与肿瘤浸润程度负相关。
层粘连蛋白是神经胶质瘤细胞从多细胞球体中迁移出来的强大促进剂。阻断a3b1整合素受体可显着减少层粘连蛋白上的迁移。用大鼠C6胶质瘤细胞进行的抗体阻断研究表明,迁移和侵袭是由b1整合素层粘连蛋白受体介导的。
Deryugina等已经发现,参与细胞粘附的整合素受体只有一个子集可以介导迁移,而这些整合素是配体特异性的。例如,在纤连蛋白上的神经胶质瘤细胞迁移严重依赖于整合素,而肌腱蛋白介导的细胞迁移则依赖于b1整合素。
基质糖蛋白腱生蛋白可以在神经胶质瘤细胞中引起抗迁移反应,这种表型由含av的整联蛋白介导。如抗体阻断研究和反义策略所证实的那样,通过控制av基因的表达,可以直接影响神经胶质瘤细胞的迁移表型。Yamamoto等人表明,整合素a3b1的不适当唾液酸化可以改变粘着斑以及粘附介导的信号转导并在体外阻断神经胶质瘤细胞的侵袭。通过选择性激活抗迁移整合素并潜在地阻断增强迁移的整合素来阻止脑肿瘤局部侵袭的这种新颖方法可能会对未来的治疗策略产生深远影响。
钙黏着蛋白是钙依赖性同型粘附受体。它们在确定组织组织中起重要作用。上皮肿瘤中钙黏着蛋白表达的降低与更恶性和高度侵袭性的表型有关。
选择素是与细胞表面的碳水化合物特异性结合并通过钙依赖的唾液酸化聚糖识别介导异型细胞相互作用的蛋白质。尽管尚未完全鉴定出目前已知的选择素的配体,但看来选择素传递的信号可以调节某些类型细胞中的基因表达。这些受体在淋巴细胞归巢和免疫调节中已显示出重要意义,但在脑发育或神经胶质细胞生物学中似乎没有作用。
免疫球蛋白超家族包括各种各样的细胞粘附受体,包括NCAM和ICAM-1(细胞间粘附分子-1)。细胞因子在体外在胶质母细胞瘤细胞中增强ICAM-1的表达。该实施例用于证明免疫系统对细胞表面分子的作用。肿瘤控制基因DCC(在结肠癌中删除)编码一种与免疫球蛋白超家族成员具有显着同源性的蛋白质。DCC诱导分化并控制细胞增殖。DCC表达的丧失与神经胶质瘤的进展相关。DCC在恶性神经胶质瘤中的表达降低,而低度星形细胞瘤主要是DCC阳性。这些发现暗示DCC可能在神经胶质瘤的进展中起作用。
除了它们在细胞结构和功能的各个方面的影响外,细胞粘附受体还可以通过信号转导途径启动细胞内生化信号传导级联,从而调节细胞的生长和分化。整联蛋白能够将生化信号从ECM传递到细胞内部。整联蛋白介导的信号与细胞因子和生长因子受体诱导的信号有很多重叠,较显着的是受体酪氨酸激酶信号转导的途径。钙黏着蛋白引发的信号转导事件也影响受体酪氨酸激酶途径以及G蛋白途径。
与大量关于整联蛋白和钙粘蛋白的研究相比,关于选择素和免疫球蛋白超家族作为信号转导者的作用的信息相对较少。然而,涉及细胞粘附分子的信号转导的新方面较有可能影响已知的信号通路。与癌症相关的发病率和死亡率主要是癌细胞异常扩散的结果。胶质瘤中粘附分子表达的调节可能提供改变细胞-细胞相互作用和细胞-ECM相互作用的可能性,这可能是操纵这些肿瘤中局部侵袭的途径。
持续发展
对于正常细胞和肿瘤细胞的分化和增殖之间的二分法已有长期的认识。星状细胞瘤细胞遵循这种相互排斥的分支,因为诱导分化导致控制生长。用佛波酯(一种通常与诱导分化相关的药物)处理神经胶质瘤细胞可控制生长,但增加迁移并增强侵袭。抗叶酸化学治疗剂也能控制生长,但只有在药物浓度提高一个数量级之后,迁移的控制作用才变得明显。 这与细胞对相同处理对生长和迁移效应的不同反应一致。值得注意的是,人神经胶质瘤细胞对转化生长因子b1的特异性受体介导的反应显示出生长控制和迁移刺激。 激活神经胶质瘤细胞运动的 ECM蛋白控制增殖。使用来自肿瘤囊肿的液体的结果表明,在肿瘤床中产生的自分泌因子导致增殖和迁徙反应,且反应曲线明显不同。后续工作已将散射因子确定为此类流体的合适成分。对生长和迁移刺激均具有相同的更佳剂量。使用生长因子,细胞毒性化学治疗剂和ECM蛋白等多种治疗方法的证据越来越多,开始促使人们认识到神经胶质瘤细胞对细胞分裂或细胞运动的承诺以及这些选择的互斥基础的显着区别在任何时候。
恶性侵袭性胶质瘤的“颅外疗法”
对神经胶质瘤细胞迁移的高度承诺伴随着增殖的减少。迁移与增殖之间二分法的一个重要含义是,旨在阻止或阻止神经胶质瘤细胞入侵的疗法可能会加速增殖。我们建议这将是抗侵入疗法的不受欢迎和不利的结果。
在神经胶质瘤细胞的增殖和运动行为之间存在逆向联系的背景下,我们考虑了促进神经胶质瘤细胞迁移和侵袭的疗法。各种ECM蛋白激活神经胶质瘤细胞运动。ECM蛋白与细胞表面的特定受体结合,这种受体的占用触发了细胞内的特定信号转导反应。可以想象,这种信号级联反应将包括细胞周期各个阶段的受控延长,甚至在其全部组成中都包括增殖停滞。除了与细胞的运动机制结合的不溶性基质分子外,可溶性因子还起着运动活化剂的作用。这样的化合物的花名册包括表皮生长因子,血小板衍生的生长因子,散布因子或肝生长因子和胰岛素样生长因子。尽管通常将这些因素中的许多因素视为刺激细胞增殖的物质,但在适当的浓度下,这些化合物会引起细胞的运动反应。
可以将参与神经胶质瘤细胞迁移反应的可溶性和不溶性药物的某些组合用于我们所说的“颅外疗法”。在这种方法中,在对原发性神经胶质瘤进行一次手术切除后,将生物工程套管植入切除腔内。可以修改套管的腔表面,以呈现出一种基质,该基质激活神经胶质瘤细胞向游荡的神经胶质瘤细胞的运动能力。细胞沿插管向上移动的越远,激活细胞向外运动的配体密度就越高。同时,含有趋化性浓度的吸引胶质瘤细胞的特定因子或因子混合物的溶液将通过套管泵入切除腔。当神经胶质瘤细胞趋化性地侵入原发性肿瘤床时,他们会遇到插管,这会导致它们从头部流出。激活神经胶质瘤细胞运动的策略也控制增殖。我的头外疗法会通过募集肿瘤细胞的迁移反应来控制肿瘤的生长。
- 文章标题:美国巴罗神经学研究所关于侵袭性,不可切除的胶质瘤细胞的思考
- 更新时间:2019-11-14 16:37:00

 400-029-0925
400-029-0925