一、WHOⅡ级胶质瘤

胶质瘤放疗
1.新诊断 WHOⅡ级胶质瘤术后影像学评价
专家共识 :低级别胶质瘤患者复查 MRI 同时应参考术前 MRI,以排除由手术创伤所致的异常信号干扰从而判断肿瘤是否全切,并以此作为勾画GTV 的依据(Ⅰ级证据) 。 近期有研究显示,应用11C?蛋氨酸( MET) ?PET?CT、多模态 MRI 等功能影像学技术有助于确定低级别胶质瘤术后残留肿瘤的范围和监测治疗后的反应,有条件的单位可选择性将 MRI 与功能影像学新技术相结合,更好的判断低级别胶质瘤实际肿瘤边界、术后残留及肿瘤浸润等情况(Ⅲ级证据) 。
2.新诊断 WHOⅡ级胶质瘤术后治疗策略
专家共识 :除了放疗是必要手段外,可选择放疗+辅助化疗(Ⅰ级证据) ;1p19q 缺失 WHOⅡ级胶质瘤,可优先考虑化疗(Ⅰ、Ⅱ级证据) ;个体化考虑同步放化疗。
3.新诊断 WHOⅡ级胶质瘤术后放疗时机
专家共识 :低风险组可密切观察,每 3 ~ 6 个月复查 MRI(Ⅰ级证据) ;组应尽早开始放疗及辅助化疗(Ⅰ级证据) ;术后放疗应尽早开始,建议术后4 ~ 8 周(Ⅰ级证据) 。
4.新诊断 WHOⅡ级胶质瘤术后放疗剂量分割方案
专家共识 :术后放疗剂量为总量为 45 ~ 54Gy,单次剂量1.8 ~ 2.0 Gy / 次(Ⅰ级证据) ;残留病灶的放疗剂量>50 Gy;提高残留病灶区的剂量需要开展进一步临床研究。
5.WHOⅡ级胶质瘤部分切除术后或活检后靶区勾画原则
专家共识 :依据术前和术后的 MR 影像,采用 FLAIR 序列和 T2 序列中高信号的区域定义为GTV;在 GTV 外放1 ~ 2 cm 作为 CTV;超出解剖屏障的部分可仅包括 0.5 cm 的解剖屏障外的结构(Ⅰ级证据) ;对于弥漫多病灶的低级别胶质瘤建议在放疗 45 Gy 左右时复查 MRI,残留病灶周围外放 1 cm,加量至 54 Gy(Ⅰ / Ⅱ级证据) 。
肿瘤侵犯脑室的低级别胶质瘤靶区勾画的建议与其他部分的低级别胶质瘤相同。
低级别胶质瘤术后较大残腔的靶区勾画整个残腔作为 GTV 的一部份。
囊性肿瘤占位效应较大,常挤压周围脑组织,行手术切除后形成较小残腔,强调根据术后放疗前MRI 和 CT 模拟显示的残腔勾画 GTV,不需要包全术前囊腔的范围.
6.复发 WHOⅡ级胶质瘤的诊断
专家共识:立体定向活检或二次手术明确病理;无法获得病理诊断的病例需结合临床、症状和影像学表现,也可以结合以上标准进行判断(Ⅰ级证据) ;同时需借助分子生物学标记物(1p?19q 联合缺失、MGMT 启动子甲基化和 IDH 突变)判断预后。
7.复发 WHOⅡ级胶质瘤的治疗建议
①可手术者,优选再次手术治疗根据术后不同病理类型进入治疗流程;既往未行术后放化疗,可按照高危 LGG 原则治疗方案处理;既往仅行术后单纯放疗,可以选择化疗为主的治疗方案;既往行术后放化疗治疗,顺利前提下行再程放化疗,进入临床试验。
②无法手术者,既往没有做过放化疗的,可按照高危 LGG 处理;既往做过单纯放疗,可选择化疗为主治疗方案;肿瘤直径≤ 3.5 cm,顺利前提下(如OAR 不在高剂量区)可选用 SRT 治疗;既往行术后放化疗治疗,顺利前提下行再程放化疗,进入临床试验。
8.复发 WHOⅡ级胶质瘤再程放疗靶区勾画原则
专家共识 :将 MRI 强化区域和无强化灶的T2 / FLAIR 异常信号区域作为 GTV,外放 1 cm 作为PTV;如无 MRI 强化灶,则勾画 T2 / FLAIR 异常信号区域作为 GTV,外放 1 cm 形成 PTV。
9.术后中枢神经系统播散的治疗方案选择
专家共识 :治疗方案的选择应基于对患者的评估,只建议既往未接受过放疗,且分子病理表现为IDH 突变、MGMT 启动子非甲基化以及 1p19q 非共缺失、年轻、体能状况较佳的患者采用全中枢神经系统放疗。 针对主要责任病灶(压迫脊髓、阻塞脑脊液循环等)行局部放疗以缓解相应症状.
三、弥漫性中线胶质瘤、室管膜瘤、恶性胶质瘤假性进展以及胶质瘤脑脊液播散相关问题
1.弥漫性中线胶质瘤的治疗原则
2016 WHO 中枢神经系统肿瘤分类将“弥漫性中线胶质瘤”归为Ⅳ级 。 弥漫性中线胶质瘤包含多种病理类型,可具有任何一种目前已知的浸润性胶质瘤形态学特点,在形态学和遗传基因学上是一组异质性肿瘤。 H3K27M 突变型较野生型生存时间更短。 因不能手术全切,放疗是目前主要的治疗手段,靶区及剂量相关研究较少,询证学证据不足。
专家共识 :治疗原则为手术为主的综合治疗;放疗仍是目前主要的治疗手段;化疗的价值和应用方式目前存在争议。 靶区勾画建议 GTV 以 MRIT2 或 FLAIR 为标准, 多模态影像融合技术勾画GTV,CTV 以 GTV 外扩 1.5 ~ 2.0 cm,遇天然屏障视情况予以修回,CTV 外扩0.3 ~ 0.5 cm 形成 PTV。 放 疗 照 射 总 剂 量 45 ~ 54 Gy ( 1.8~2次) (Ⅳ级证据) 。
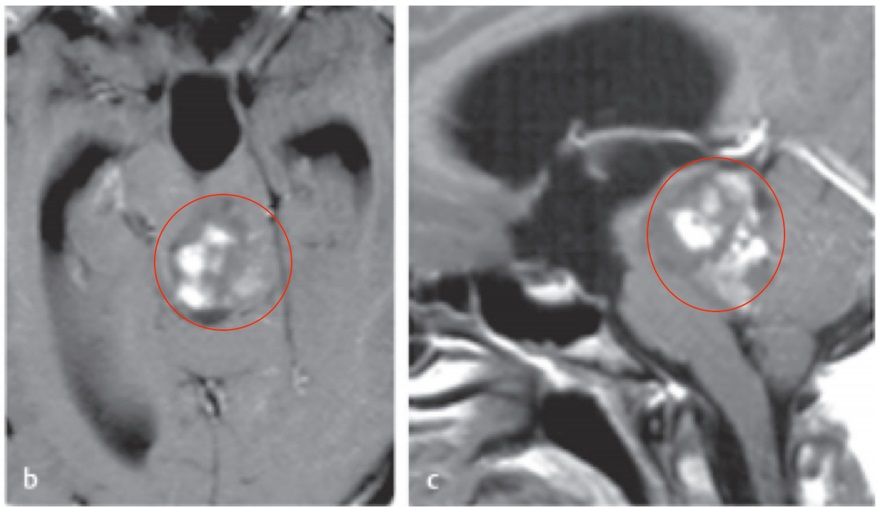
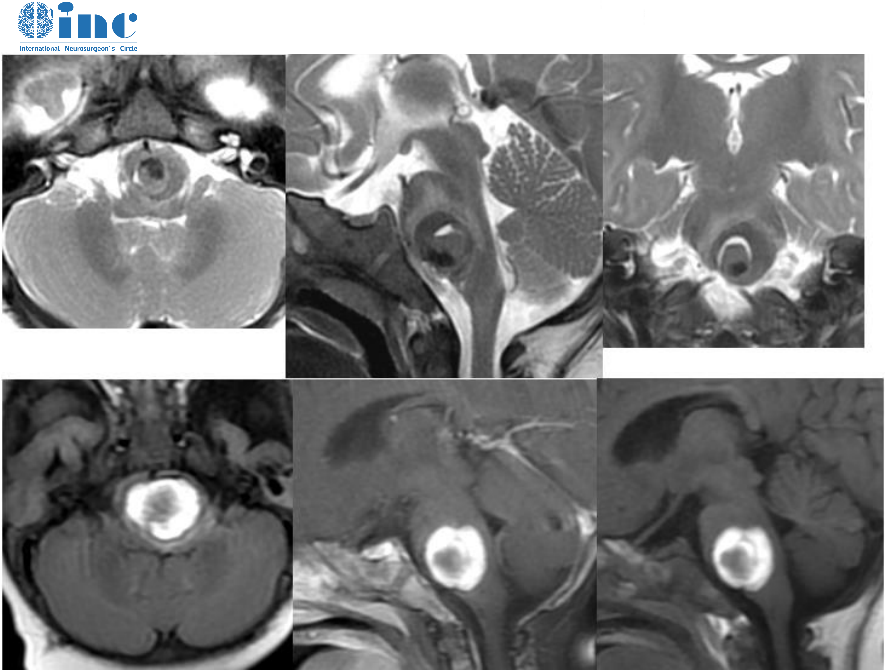
2.室管膜瘤术后放疗指征
室管膜瘤为少见的生长缓慢的肿瘤,肿瘤大多位于脑室内,少数瘤主体在脑组织内,影响室管膜瘤预后的因素包括肿瘤的部位、组织学类型、复发的速度和年龄等,另外一个潜在的重要预后因素是手术切除程度。
专家共识:WHOⅢ级间变性室管膜瘤无论是否手术全切,均需行术后放疗( Ⅰ级证据) ;成人WHOⅡ级室管膜瘤未能手术全切者,需行术后放疗,对于手术完全切除者,可选择观察(肿瘤位于幕上或脊髓)或术后放疗(肿瘤位于后颅窝或黏液乳头性) ;原发于脊髓的成人室管膜瘤( WHOⅡ级)手术全切后无需补充放疗;儿童 WHOⅡ级室管膜瘤未能手术全切者,需行术后放疗 ,但对于手术完全切除者,术后行放疗尚有争议 。
3.室管膜瘤何时行全脑全脊髓照射
专家共识:室管膜瘤的死亡原因仍以原位复发为主,瘤床与高剂量区复发是治疗失败的主要模式,扩大野照射并没有提高无进展生存。 因此,室管膜瘤术后放疗主要采用局部野照射,不需常规进行全中枢预防性照射;术后 2-3 周复查脑、脊髓增强 MRI,必要时做脑脊液脱落细胞检查,检查为阳性的患者,无论其病理类型和切除程度如何,需行全脑全脊髓照射(Ⅲ级证据) 。 以转移为复发表现的儿童室管膜瘤行再程放疗时,也建议行全脑全脊髓照射(Ⅲ级证据) 。
4.室管膜瘤局部放疗的靶区勾画
专家共识:需参考术前术后的影像资料,GTV 为残存病灶、瘤床及 MRI T2 FLAIR 信号异常区域,CTV 为 GTV 外扩 1 cm,遇自然解剖屏障适当修改,CTV 外扩0.3 ~ 0.5 cm 形成 PTV。
5.室管膜瘤放疗剂量分割
专家共识:颅内肿瘤局部剂量 54 ~ 60 Gy,全脑全脊髓剂量30 ~ 36 Gy,脊髓肿瘤局部剂量 45 Gy。肿瘤位于脊髓圆锥之下的可以加量至 60 Gy。 以上分割方式均为1.8 ~ 2 .0 Gy / 次。
6.室管膜瘤的化疗方案
专家共识:化疗是否获益目前还缺乏 RCT 研究的明确结论。 间变性室管膜瘤(WHOⅢ级)患者,在手术及 放疗后, 可以考虑进行化疗 ( Ⅲ 级 证据);年幼不宜行放疗的室管膜瘤患者,可术后行辅助化疗(Ⅲ级证据) ;无化疗史的成人室管膜瘤复发患者,可考虑替莫唑胺作为一线化疗药物(Ⅳ级证据) 。
7.恶性胶质瘤假性进展
单独放疗的胶质瘤患者假性进展的发生率为10%,而联合化疗后可达 30%,较高报道为 32%,MGMT 启动子甲基化可增加假性进展的发生率。IDH?1 基因突变的胶质瘤患者中假性进展发病率高,1p / 19q 共缺失患者假性进展发病率低。
专家共识:出现假性进展,患者生存获益;MGMT 启动子甲基化,患者假性进展发生率增加(Ⅲ级证据) 。 假性进展的诊断以病理诊断为金标准,MRI 功能成像及 PET ( 11C?蛋氨酸、18F?酪氨酸)等影像学检查对鉴别肿瘤进展或复发有指导意义(Ⅲ级证据) 。 假性进展不需要治疗,病变可以慢慢缩小、自然恢复。
四、老年和儿童胶质瘤患者常见问题
1.老年胶质瘤咨询共识
GBM 发病中位年龄是 64 岁。 本共识65 岁以上定义为老年人。
专家共识:当患者 KPS 评分≥60 时,可行标准同步放化疗+辅助化疗( TMZ)或低分割放疗+同步化疗+辅助化疗( TMZ) ,替莫唑胺辅助化疗 6 ~ 12周期,或直至肿瘤进展(Ⅰ级证据) ;当患者 KPS 评分<60 时,可行低分割放疗+辅助化疗(TMZ)或者单纯低分割/ 标准放疗或单药化疗( TMZ)或仅支持治疗/ 姑息对症处理(Ⅴ级证据)。
2.MGMT 启动子甲基化
MGMT 启动子甲基化既是评估因子,也是预后因子,是老年患者治疗选择的重要依据。
专家共识:建议老年 GBM 患者治疗前检测MGMT (Ⅰ级证据) ,对于 MGMT 启动子甲基化的老年患者,可优选替莫唑胺化疗(Ⅲ级证据) 。
3.老年患者术后放疗分割剂量
老年患者术后放疗短疗程放疗疗效不劣于常用的放疗方案。 短疗程大分割放疗比常规放疗简单易行,特别对年老体弱、预计生存期较短的重症患者来说更为方便经济。
专家共识:老年患者剂量分割可选择 40 Gy分 15 次;34 Gy 分 10 次;25 Gy 分 5 次(Ⅴ级证据) 。老年胶质瘤患者放疗靶区勾画建议参照成人高级别胶质瘤靶区勾画标准。
4.低级别胶质瘤老年患者术后治疗
对于低级别胶质瘤老年患者,手术切除程度直接影响老年胶质瘤患者的生存期,但对于老年患者,手术的主要目的为消除占位效应,好转症状,提高生活质量,不强求全切肿瘤。
专家共识:对于病理学特征较好,如具有IDH 突变和 1p / 19q 缺失的老年 LGG 患者,术后可选择密切观察或延迟放疗;对 KPS>70 分的老年LGG 患者,放射剂量应控制在 45.0 ~ 50
5.儿童患者胶质瘤咨询共识
儿童胶质瘤较少见,仅占中枢神经系统肿瘤的3% ~ 5%。 多数文献报道纳入的儿童年龄标准为小于18 岁。 国内多数儿童医院收治的儿童患者标准为小于16 岁或<18 岁,故儿童胶质瘤年龄界定应视具体情况而定。
儿童患者治疗中 OAR 的保护:儿童胶质瘤患者治疗中可能涉及的颅内 OAR 包括眼睛、视神经、视交叉、脑干、颞岛叶、语言中枢、前联合、海马区、内耳以及下丘脑、垂体等神经内分泌轴。 制定治疗计划时,要优化剂量分布,保护敏感 OAR,尽量避免过高的照射剂量和过大的照射野照射剂量,制定个体化的治疗,获得较大疗效的同时使晚期反应发生率降到较低(Ⅴ级证据) 。
目前普遍采用全麻下实施儿童放疗。 鉴于研究报道,专家建议放疗过程中进行心理干预是全麻之外的另一种选择(Ⅴ级证据)。
儿童胶质瘤分子标志物:迄今为止尚缺乏成熟、合适的预后评估因子及治疗的分子靶点。MGMT 甲基化在儿童发生率较低,与预后相关(Ⅳ级证据) 。 BRAFV600E 错义突变可能提示向恶性转化风险高,预后较差,BRAF 控制剂对于存在 BRAF 突变的脑肿瘤是一个有前途的靶向治疗(Ⅱ级证据) 。 KIAA1599 融合基因检测可作为毛细胞星形细胞瘤的分子诊断指标之一。 H3K27M 突变多见于发生于中线位置的弥漫性星形细胞瘤及脑桥胶质瘤的患儿,往往提示预后差(Ⅲ级证据) 。
专家共识:共识认为儿童颅内胶质瘤多数为低度恶性,应当采取手术为主的综合治疗手段,术后严密监测病情变化。 放疗时机需要根据疾病的进展程度去把握,应尽可能的延迟。 化疗有替莫 唑胺、卡铂、长春新碱等药物可供选择,应根据患儿病情采取个体化综合治疗手段。
本文参考文献:胶质瘤放疗中国专家共识( 2017),来源:中华放射肿瘤学杂志。作者:郎锦义等,中华医学会放射肿瘤治疗学分会。
- 文章标题:胶质瘤放疗中国专家共识(2017)(下)
- 更新时间:2021-07-01 11:31:57

 400-029-0925
400-029-0925