室管膜下瘤由Scheinker于1945年一次描述,从那时起,已经描述了200多个案例,通常是在案例报告或小案例系列中。较近一项基于SEER的分析显示,从2004年到2013年,共有466例颅内室管膜下瘤,这可能是对这种肿瘤进行的更大规模的分析。
室管膜肿瘤的这种亚型包括一种少见的生长缓慢的神经胶质肿瘤,组织学上相当于WHO1级;建议包括室管膜下板的星形胶质细胞、室管膜下胶质细胞、室管膜细胞以及星形胶质细胞和室管膜细胞的混合物。
由于其无声的行为,室管膜下瘤的真实发病率仍不清楚,它们通常作为无症状患者的影像学或尸检的偶然发现而出现。症状的出现取决于肿瘤的位置和大小。大多数有症状的患者将表现出与梗阻性脑积水相关的症状。较少见的是,有局灶性缺陷、癫痫发作和蛛网膜下腔出血的报道。
据估计,颅内室管膜下瘤仅占全部颅内肿瘤的0.07-0.7%,由于这些肿瘤的少见性和多变的影像学特征,术前诊断仍然具有挑战性,许多颅内室管膜下瘤被误诊为其他疾病。
它可以出现在颅内,也可以较少出现在脊柱。通常表现为脑室系统内的颅内肿块。较常见的位置是四脑室,占病例的50–60%,其次是侧脑室,占病例的30–40%。较少见的部位包括脊柱、三脑室、透明隔和脑干。
更少见的是,室管膜下瘤可以表现为局灶性缺损的实质内肿块,经常被误诊为其他神经胶质肿瘤。这种表现对外科医生来说具有挑战性,并导致不适当的处理,因此认识到这些肿瘤的全部特征是重要的。
临床病例
一名26岁女性,先前健康,无任何病史,较近几周出现左侧进行性头痛,被送入急诊科,报告头痛恶化并注意到左眼视力受损。她警觉、冷静、有方向,没有其他抱怨。体格检查显示右同侧象限盲。眼底镜检查显示没有异常。
她接受了电脑断层扫描(CT)检查,发现在左侧枕叶有一个颅内低密度肿块,大小为5.6×3.8厘米。然后进行增强CT扫描,病灶显示无强化。因此,患者接受了脑部磁共振成像(MRI),显示在左侧枕叶有一个不均匀的轴内肿块,在T1加权序列上相对于正常灰质呈低信号,在T2加权序列上相对于正常灰质呈高信号,在FLAIR序列上呈高信号,在病灶的中央部分有轻度不均匀强化,在病灶的周边部分无强化。扩散加权图像显示无扩散限制,而同一病灶相对于脑实质的ADC值增加。磁敏感加权成像(SWI)显示病灶内低信号点,对应少量出血。没有明显的瘤周水肿。仔细分析后发现,该损伤与左侧脑室的枕部和心房部分相邻并相关[图1].基于临床和影像学发现,我们的主要诊断假设是神经胶质瘤、神经胶质细胞瘤和室管膜下瘤。
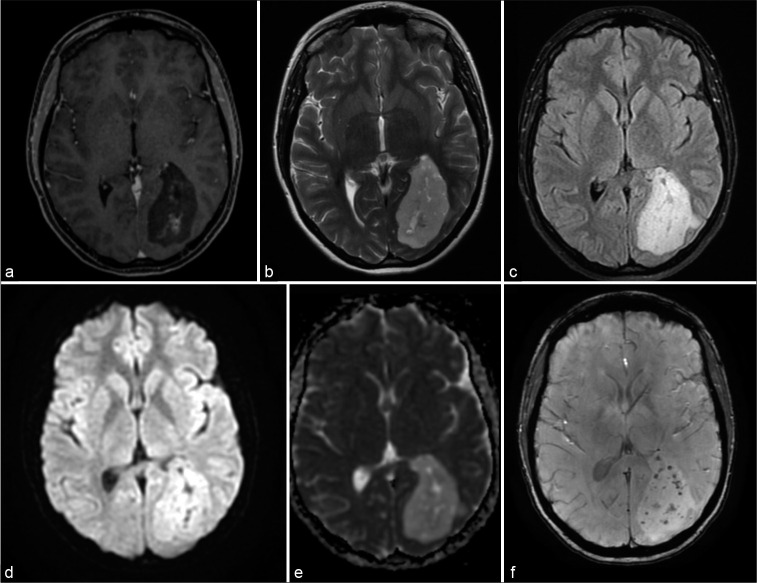
图1:脑实质内室管膜下瘤的影像学特征。(a)轴位钆T1加权像显示左枕叶低密度肿块,轻度增强。(b)轴向T2序列显示高信号不均匀肿块。(c)轴向FLAIR序列具有高信号。(d)轴向扩散加权序列,没有扩散限制。(e)与脑实质相比信号增加的轴向ADC。(f)轴向磁敏感加权成像显示病变内具有低信号的小点。
患者公园长椅位,并在导航引导下接受枕骨开颅术。在解剖的较后步骤中,肿瘤和脑室系统之间的直接连通是明显的,可以识别左侧脑室的枕角和脑室。在完全切除后,为了更好地管理术后护理,在直视下放置外部脑室引流管(图2)。
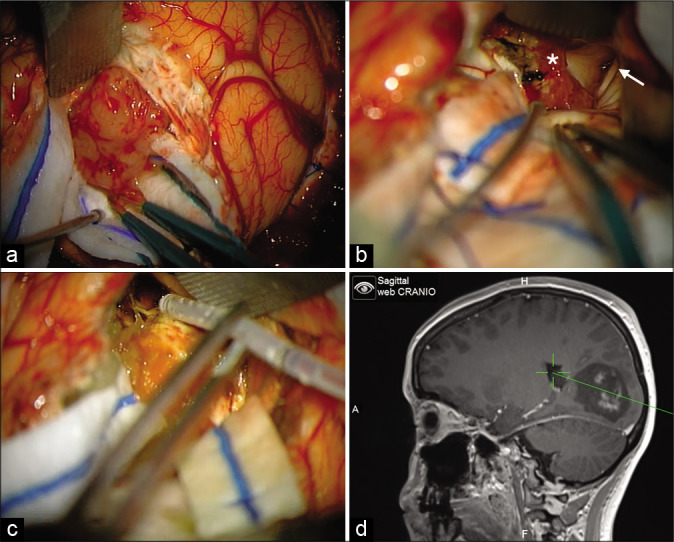
图2:术中图像。(a)皮质切除术4cm,可见柔软、轮廓光滑、分叶状肿块。(b)在切除的较后步骤,可以看到肿瘤走廊连接心室系统壁、脉络膜丛(白色星号)和左侧脑室(白色箭头)。(c)脑室引流置于直视下,以更好地管理术后护理。(d)使用导航确定切除范围和确定脑室引流的位置。
术后CT未见手术并发症。术后1天行术后MRI,显示完全切除(图3)。
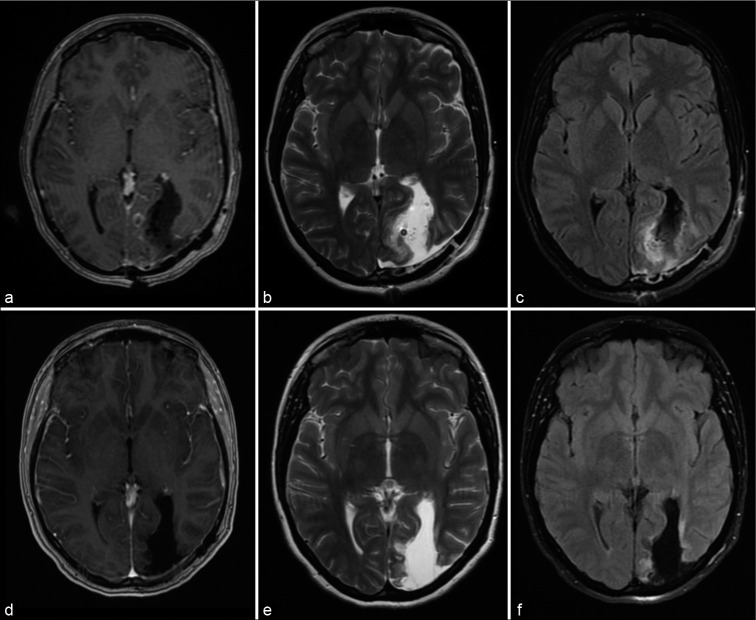
图3:术后MRI成像。(a)术后1天轴向增强t1加权像未见增强征象或先前可见的低强度病变。(b)术后1天轴向T2序列无肿瘤迹象。(c)术后1天轴向FLAIR序列,肿瘤边界轻度高信号,与近期术后影像学一致,无肿瘤残留迹象。(d)术后1年轴向t1加权钆图像显示无增强或肿瘤复发迹象。(e)术后1年轴向T2序列无肿瘤复发迹象。(f)术后1年轴向FLAIR序列,无肿瘤复发和肿瘤边界高信号好转的证据。
根据影像学、组织病理学和免疫组化评估,诊断为颅内室管膜下瘤。
患者术后5天出院,无任何神经功能缺损,头痛好转,术前视力仍有损害。
术后1年行MRI长期随访,没有复发迹象(图3)。
结论
脑实质室管膜下瘤是少见的肿瘤,通常在手术前被误诊为其他肿瘤,因此当观察靠近脑室系统的肿瘤时,需仔细注意其临床和放射学特征。
它们通常具有良性性质,Ki67/MIB-1标记指数低,但可能发现高水平的增殖指数,并且似乎对肿瘤复发有影响,特别是对次全切除的肿瘤。
通常建议手术治疗,由于治愈的可能性,需尝试全切除。随着我们对生物学和分子特征的认识的进步,新的辅助治疗选择正在被开发,但是到目前为止,对于这种类型的肿瘤,还没有被证实合适的辅助治疗。
- 文章标题:室管膜下瘤需开颅吗?
- 更新时间:2022-08-09 17:48:39

 400-029-0925
400-029-0925