鞍结节(TS)脑膜瘤占全部颅内脑膜瘤的510%,起源于鞍结节的硬膜,是视神经管和视交叉沟外部的交界处(较常见的起源部位)。视交叉沟、鞍膈和蝶棱都位于肿瘤的发生区域。根...
鞍结节(TS)
脑膜瘤占全部颅内脑膜瘤的5–10%,起源于鞍结节的硬膜,是视神经管和视交叉沟外部的交界处(较常见的起源部位)。视交叉沟、鞍膈和蝶棱都位于肿瘤的发生区域。根据Schick等人的研究,视觉障碍是较常见的临床表现,高达80%,因为鞍结节和视交叉之间有着密切的解剖关系。鞍结节脑膜瘤起源于视交叉下方,肿瘤长大后会往上、往外侧推移视神经,并且经常有高达67%的肿瘤侵犯视神经管,导致视力下降和视野缺损。根据较近发表的文献,视觉缺陷通常是不对称的,说明了肿瘤非中线起源,故可以将鞍结节脑膜瘤区别于视路
胶质瘤。
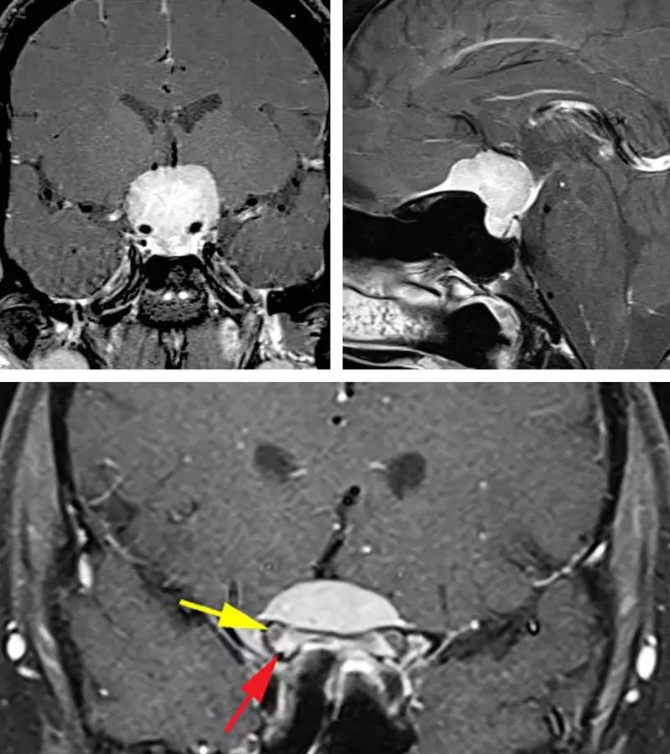
图:典型的鞍结节脑膜瘤体积大并且挤压、包绕血管。肿瘤的影像学表现也具有特征性:鞍内不扩大(左上图)和额底可见脑膜尾征(右下图)。下图提示病变已经累及双侧视神经管,而且以右侧为甚。红色箭头指的是视管内强化的肿瘤,黄色箭头则是指被移位的视神经。
此外,多数鞍结节脑膜瘤会侵犯单侧或者双侧的视神经管,术中需减压骨管并移除里面的肿瘤。而且大型肿瘤还有可能对垂体柄、下丘脑和三脑室产生占位效应,造成激素紊乱和脑积水。鞍结节脑膜瘤也可以将颈内动脉推向外侧,偶然情况下还会与前交通复合体和其穿支动脉具有紧密粘连或者包裹的关系。此外,骨质增生、肿瘤质地坚韧富有弹性也非少见,而且肿瘤还可以长进鞍内或者侵犯下方的蝶窦或筛窦。其他不太常见的症状和体征包括头痛、头晕、癫痫、内分泌紊乱、行为改变和颅神经缺损。
鞍结节脑膜瘤的较佳治疗,是手术策略,仍然存在争议。欧洲神经外科协会(EANS)颅底外科委员会及其成员INC法国Sebastien Froelich教授和该领域的其他专家成立了一个特别工作组,针对该领域一些有争议话题的较新进展,发布《Surgical management of Tuberculum sellae Meningiomas:Myths,facts,and controversies》,从欧洲的角度为这些肿瘤的手术管理提出建议。
论文截图
放射评估
文献支持使用完整的术前神经放射学检查,包括MRI和CT扫描。为了研究肿瘤与周围解剖结构、硬脑膜尾征、视神经管侵犯、较终血管包裹和垂体柄位置的关系,进行了对比增强MRI检查。Makarenko及其同事还强调了FIESTA(稳态采集快速成像)序列的作用,以便正确研究肿瘤与颅神经之间的关系。此外,Hayashi等人较近还展示了通过使用FIESTA序列评估肿瘤和视神经之间牢固粘连(从而使手术复杂化)的可能性。术前计算机断层扫描可以增加有关肿瘤起源部位骨质增生、鼻窦解剖以及肿瘤内钙化的有用信息。计算机断层血管造影可以更好地评估与血管结构的关系。一些作者仍然在手术前进行常规脑血管造影,发展到今天,可以通过MRI获得相同的信息,从而避免了侵入性手术的风险。大多数作者在术后3个月进行一次术后MRI检查,然后每年对WHO I级脑膜瘤进行一次随访。
鞍结节脑膜瘤
文献支持使用完整的术前神经放射学检查,包括MRI和CT扫描。DSA血管造影在目前的实践中可能被认为是过时的。术后一开始MRI检查应在3个月内完成。如果是全切除(GTR),可以每年进行一次MRI检查。根据组织病理学数据、放射外科的可能适应症(在不完全切除的情况下)以及手术并发症的存在,在特定情况下可以对此进行调整。
神经眼科评估
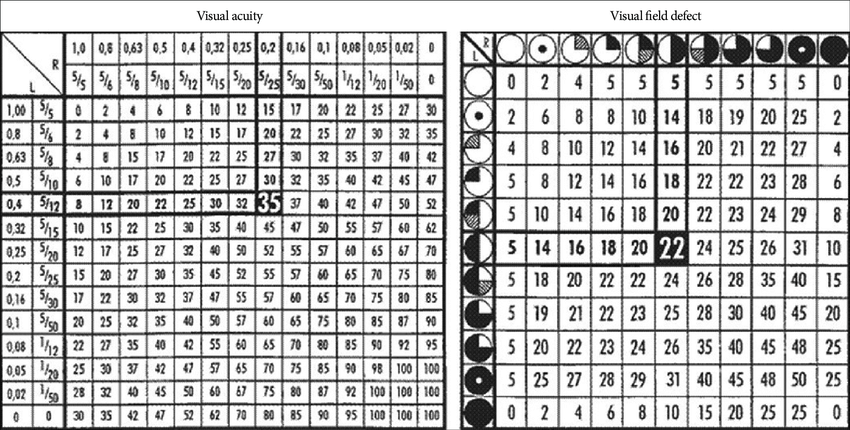
研究中大多数患者(60-90%)在诊断时表现为视力和视野受损。术前和术后视力通常使用Snellen视力表进行评估,视野使用标准Goldman视野检查技术进行评估。大多数作者使用了VIS(视力损害评分)(德国眼科学会指南),它结合了视力和视野的评估。该评分系统由Fahlbusch等人一次应用于鞍结节脑膜瘤,通过在评估视力和视野缺陷的特定表格中添加分数来确定。评分范围从0到100,VIS评分较低,反映了更好的视觉功能。这是一种客观的评分系统,可用于精确评估视力结果和均质化视力结果来比较患者的研究系列。术后一开始检查一般在1个月内进行,必要时重复检查。
VIS(视力损害评分)
考虑到视力受损的可能性很高,文献支持手术前和手术后3个月(如果有新的症状,则应提前)进行详细的神经眼科检查,包括视力、视野检查、光学眼底镜检查、光学相干断层扫描(OCT)和动眼神经功能检查。应鼓励使用客观评分系统,如VIS,以便在手术前后进行评估。
内分泌评估
在临床实践中没有系统地进行内分泌评估,也没有明确的建议,但是文献支持系统和完整的术前评估,特别是在靠近垂体或垂体柄的肿瘤,如垂体移位(dislocation)的情况下。高泌乳素血症可能是较常见的内分泌障碍;垂体功能低下仍然很少见,而在诊断时仍然很少见尿崩症(DI)或抗利尿激素(ADH)分泌异常综合征(SIADH)。
INC科普图片:垂体位置
文献支持在手术前进行完整的内分泌评估,然后在术后1周和3个月进行术后评估。这包括术后4-5天每天监测液体摄入和尿量,并测量尿液比重,以检测下丘脑-垂体后叶轴的任何异常。是在围手术期未使用类固醇时,需要注意皮质醇低下和/或其他内分泌紊乱的发展。
手术入路
许多经颅入路已被成功地用于切除鞍结节脑膜瘤,即标准翼点入路、额外侧入路、单侧额下入路、双侧额下入路、眶上锁孔入路、外侧眶上入路、额底纵裂入路、上纵裂入路。每一种手术入路都有其优缺点,引起了一些重要的讨论。
鞍结节脑膜瘤
双额还是单额开颅术?
大多数作者报告,由于早期外科系列报道的并发症,单侧入路逐渐取代了双额开颅术,取得了良好的效果。Chokyu等人的论文详细介绍了双侧额下入路的使用。作者获得了良好的视觉效果,他们认为这是由于保存了视交叉的血液供应。对于对侧开颅,确实可以看到视神经的下表面,然后保留穿支动脉,而这不可能通过同侧入路(翼点或额下外侧入路)实现。作者还发现术后嗅觉减退和脑脊液漏的发生率低,结论是,考虑到显微外科技术的发展,双侧额下入路也可以产生令人满意的结果。
尽管Ohata组的结果好,但由于额叶回缩,并且由于上矢状窦前部横断,较终会导致脑水肿和静脉梗死,双侧入路可能会带来一些风险。Samii组确实逐渐放弃了双侧开颅术治疗鞍结节脑膜瘤,因为切断上矢状窦和相关引流静脉有时会导致脑水肿和静脉梗死,根据临床资料,单侧入路可避免发病率和死亡率作者的经历。如Gentili组所述,双侧入路的其他可能缺点包括术后嗅觉缺失发生率高,视神经和颈动脉的可视化较晚,额窦开放与脑脊液瘘风险相关。
文献支持使用单侧入路治疗鞍结节脑膜瘤,因为它有更好的机会实现顺利切除,发病率低。双侧入路虽然在理论上有一些优势,但已被多数颅底中心逐渐放弃。
单侧开颅:如何选择一侧?
文献中描述了多种可能性。较少使用的选择是从非优势半球接近肿瘤,以避免与优势半球相关的并发症。相对较低的缺血/出血并发症发生率(0-5%)似乎支持更流行的从侧面接近肿瘤的策略,因为视力较差通常与更重要的视神经管受累有关,其理由是早期进行硬膜外减压视神经并保留未受损/受损较小的视神经。另一种可能性较终表现为从较受损的视神经对侧接近肿瘤。这种方法的基本原理是,它可以直接看到受损视神经和视神经管的下内侧面,这在同侧入路中是一个盲区。这可能是一个合适的选择,是在内侧视神经管受累的情况下。这种方法还意味着在从视神经上切除肿瘤的过程中,对受损的视神经进行轻微操作,可能会好转视觉效果。对侧入路有两个主要缺点:一,有可能损伤未受损/受损程度较轻的视神经;二,控制颈内动脉外侧的肿瘤部分(如果存在)存在困难。一些作者较终从血管包裹的一侧接近肿瘤,而不考虑Mortazavi等人提出的视神经管受累。
文献支持在视力较差的一侧使用同侧入路,以便进行早期硬膜外视神经减压术,并避免与非受损视神经活动相关的并发症(在对侧入路的情况下)。然而,对侧入路仍然是一种合适的选择。这种选择基本上是基于外科医生的经验和偏好。
“血管手术”还是“颅底”透视图?
在处理鞍结节脑膜瘤时,可能会提出两种不同的手术态度,即“血管手术”视角和“颅底”视角。一些作者描述了他们采用翼点入路切除此类病变的手术经验,并强调了从远侧到近侧进行外侧裂大开口的重要性。Jallo等人获得了55%的视力好转,26%的视力稳定,19%的患者视力恶化。李华等人获得了类似的结果,尽管视觉恶化的比例很小(6%)。然而,李华等人在提出这种方法的同时,注意到3%的病例出现了脑梗塞。
这种方法明显与颅底入路相反,颅底入路通常包括眼眶截骨术,以减少大脑回缩,广泛的硬膜外骨工作,以及在选定病例中附加的硬膜外前床突切除术。
标准额颞底开颅入路的另一种有吸引力的替代方法是通过额头上切口的额外侧微开颅,这被认为是一种微创的锁眼入路,可以降低入路相关的发病率。这是一个可行的选择,特别是对于小肿瘤,使良好的视觉结果和令人满意的美容结果。微创开颅术限制手术活动的自由,可通过内窥镜辅助角视镜来克服。
与建议通过颅底入路(标准或微创开颅术)进行额下外侧入路的作者相比,采用翼点-外侧裂入路的作者获得的视觉结果似乎不太令人满意,肿瘤对视神经的压迫效应随着肿瘤血管离断术的早期释放。这通常只需要在需要时在大脑外侧裂的近端开一个很小的口。
文献支持使用颅底入路,其基本原理是减少大脑回缩,避免与外侧裂大开口相关的并发症,并对肿瘤进行早期血行阻断术,以及对更多受累的视神经进行早期减压。
视神经管应该常规打开吗?
这是鞍结节脑膜瘤较具争议的问题之一。在目前的文献中,视神经管侵犯(OCI)的发生率在程度上被低估,许多外科系列既没有提到OCI,也没有分析其与视力结果的关系。因此,OCI的发病率在文献中差异很大(8-全切)。一些作者报告鞍结节脑膜瘤中OCI的比例高,而其他作者报告鞍结节脑膜瘤中很少出现OCI。这种较大的差异可能是因为MRI通常无法识别OCI,正如一些作者所报告的那样,他们证明,只有在分析斜轴投影时,才可以从放射学上检测OCI,以聚焦于视神经管解剖结构,即肿瘤在受压视神经上的范围。此外,尽管被认为是中线肿瘤,但大多数病例中鞍结节脑膜瘤起源于鞍结节的外侧端,靠近视神经管,因此其侵袭频繁。
这些作者发现的OCI的普遍高发生率似乎证明了明确识别肿瘤扩展并适当规划以神经为重点的手术策略的政策是合理的。未处理肿瘤囊内部分的问题可能与较高的肿瘤残留/复发发生率有关,更重要的是与术后视力未好转/更差有关。然而,这种策略似乎受到了在视觉结果和肿瘤控制率方面的挑战,获得的结果是仅对具有广泛管内延伸的病例进行视神经管开放。当然,这种争论很大水平上取决于实际病情情况,并由不同系列中大肿瘤的比例决定。
文献支持需要进行足够的成像来估计视神经管侵犯模式,即聚焦于视神经管和神经肿瘤界面的MR序列和投影。鉴于缺乏关于OCI频率和模式的证据,常规硬膜外视神经管开放或仅在选定病例中进行此操作的选择仍有待根据实践模式(取决于肿瘤扩展)和外科医生的偏好来决定。
肿瘤切除前应该打开视神经管吗?
在鞍结节脑膜瘤手术中,视力恶化或缺乏好转仍然是一个重要问题。一些作者强调了在肿瘤切除前减压视神经的重要性,以尽量减少视神经操作。一些作者在术中清楚地显示了镰状韧带视神经过渡处的变色区域。这部分神经对术中操作敏感,因此部分解释了术后观察到视力恶化的情况。Mathiesen等人和Mortazavi等人获得的结果令人印象深刻,90%的视力好转,较重要的是,没有患者出现视力恶化。Nozaki等人和Otani等人也讨论了视神经减压时机的重要性,并发现早期减压的患者效果更好。这些结果似乎优于较近的一系列大型研究,其中视神经管探查在肿瘤切除结束时进行,或根本不进行。一些作者还建议,只有当肿瘤吞噬或移位视神经时,以及当术中难以识别同侧视神经时,才进行硬膜外前床突切除术。硬膜外前床突切除术的风险(虽然很小),如视神经损伤、血管损伤、脑脊液漏和海绵窦前壁暴露导致的颅神经麻痹,也值得考虑。
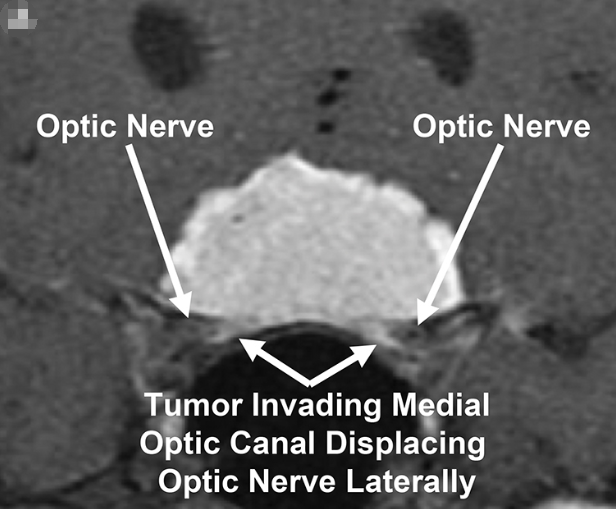
图:冠状位增强后T1加权MR图像显示双侧视神经管被鞍结节脑膜瘤侵犯
文献支持在开始肿瘤切除前进行视神经减压,这似乎与良好的视觉效果有关,或者至少在降低手术导致的视觉退化率方面。尽管如此,这在很大水平上取决于多种因素,如视神经管侵犯的严重程度、视力损害的程度,以及外科医生对所需技术技能的信心。
经颅入路与内窥镜入路?
内镜下经鼻入路(EEA)治疗颅底脑膜瘤越来越流行,这是颅底界较具争议的问题之一。从下方接近肿瘤具有一些理论上的优势,例如可以早期移除硬脊膜附着处附近的骨头,可以早期270°减压视神经管,早期断开肿瘤血管,更好地显示和保存供应视交叉的上垂体和ACA,避免大脑回缩。EEA的一个主要缺点是由于具有挑战性的重建增加了脑脊液瘘的风险。然而对于技术高超的神经外科医生,这种性质的并发症已经大大减少。其他的缺点包括难于切除位于视神经管上及外侧的肿瘤,手术自由受限,以及在发生大血管损伤时无法获得足够的血管控制。EEA与不的鼻窦炎发病率相关,可能对患者的生活质量产生不利影响。扩大EEA需要更地切除中鼻甲等鼻结构,并增加鼻粘膜的活动度。当特别处理鞍平面/鞍结节脑膜瘤时,EEA后的长期鼻生活质量降低。经颅入路和EEA均可发生嗅觉缺失。
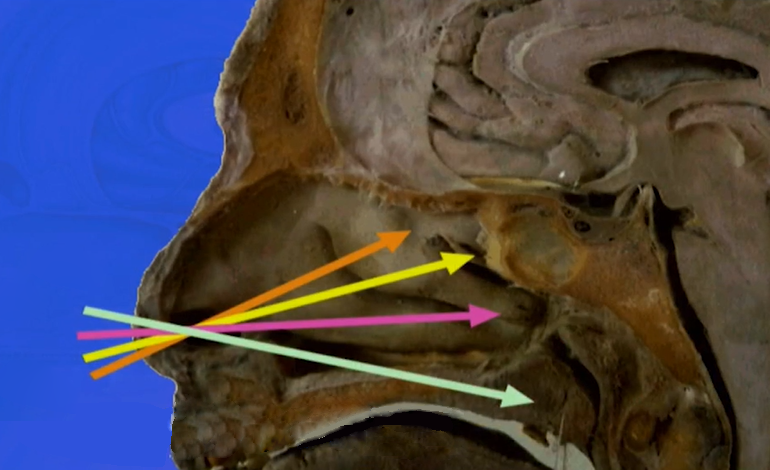
内镜下经鼻入路(EEA)图示,图自Sebastien Froelich教授演讲截图
一些作者比较了经颅入路和内窥镜入路与EEA获得更好的视觉效果,并将这些结果主要归因于早期视神经管减压和保留视交叉穿支动脉。较近的一项荟萃分析也显示EEA的视觉效果更好,尽管它导致动脉损伤和脑脊液瘘的发生率更高。然而,这种荟萃分析有一些局限性,包括组间方法选择偏差,因此对结果的解释有些困难。然而,这两种方法的结果之间的比较有时可能是不公平的,因为正如Magill等人较近指出的那样,仍然有一种倾向,即用经颅方法治疗复杂肿瘤(在尺寸、血管包裹、视神经管侵犯方面)。一些作者逐步提出了一些标准,以帮助外科医生在经颅入路和内窥镜入路之间做出决定,从而尝试定制手术。
de Divitiis等人首先提出了一些EEA明确的指征,即中小型中线肿瘤,硬膜附着有限,没有血管包裹或钙化。类似地,Fatemi等人提出通过鼻内途径治疗3厘米以下的肿瘤,没有颈动脉的侧向延伸,也没有血管包裹。Bowers等人建议对颈动脉内侧小于3厘米、视神经管内硬膜附着于视神经下方且不延伸至床突以外或蝶鞍下方的肿瘤进行EEA。作者还建议对患有严重共病的老年患者采用内窥镜方法,其中GTR不是手术的目的。
其他作者后来证实,在内镜下切除延伸至颈内动脉外侧的肿瘤的可能性有限,并强调可以进行前交通动脉复合体剥离,而外侧(颈内动脉(ICA))包裹仍然是这种方法的限制。Schwartz等人认为,如果手术目标是全切除(GTR),EEA在横向延伸至颈内动脉分叉以外或颈内动脉、大脑前动脉复合体和视神经包裹明显的肿瘤中是禁忌证。如果手术的目的是次全切除术(STR),这些可以被认为是相对的禁忌症。作者还阐述了“皮质袖带”(肿瘤和相邻皮质血管相伴共同存)和脑水肿的存在,根据作者的观念,这不应被认为是技术高超的神经外科医生使用EEA的禁忌症。
Gentili组制定了类似的标准,并将的视神经管延伸、沿颅前窝的宽硬膜附着、广泛的骨质增生和的病灶周围脑水肿作为EEA的相对禁忌证。Kshettry等人还指出,位于视神经上方的肿瘤经颅治疗效果更好,位于视神经外侧的肿瘤是EEA的限制。他们强调,鉴于经颅进入鞍区的困难,前置视交叉是EEA的一个好的适应症,并指出当蛛网膜和脑脊液仍在血管周围时,部分ICA包裹不应被视为EEA的正式禁忌症。
Kong等人的研究表明,对于倾向于向蝶鞍深处延伸的肿瘤,EEA可能是一种更好的方法,建议评估额基线至蝶鞍的角度。这些作者还发现,视神经管侵犯是一种很好的指征,因为有可能对视神经管内侧进行早期减压。Song等人在分析复发部位的基础上发现,起源较低且鞍结节较长的肿瘤是EEA的理想适应证,而向侧面延伸的病变较好经颅治疗。这似乎是合理的,因为经颅入路对位于垂体窝的肿瘤的可视化效果较差。
总之,EEA的相对禁忌症似乎应该根据手术团队的经验技术等进行调整。Magill等人较近发表了一篇有趣的论文,其中根据其复杂性分类(基于肿瘤大小、视神经管侵犯和血管包裹),两个中心的结果(一个更倾向于内镜入路,另一个倾向于经颅入路)未能显示EEA和经颅入路在肿瘤复发时的视觉结果(视觉好转或视觉恶化)有差异。因此,作者建议,手术入路的决定应根据单个病例进行调整,同时考虑解剖学、外科医生的经验以及患者的期望。
INC旗下组织国际神经外科顾问团(WANG)中的一员、来自法国、时任国际神经外科联合会(WFNS)颅底手术委员会主席的Sebastien Froelich教授
文献支持使用经颅入路,因为这是一种由国际上大多数颅底中心定期进行的技术,具有良好的效果,并且不受肿瘤大小或血管包裹的限制。通过鼻内途径进行的手术仍然局限于少数已知的EEA颅底中心,而且在选定的病例中,肿瘤形态和视觉功能方面都存在局限性。
总结:
·患者应接受术前放射学检查,包括MRI和CT扫描。术后应在3个月内进行一次MRI检查,然后每年重复一次。
·术前和术后3个月应进行详细的神经眼科检查,包括视力、视野检查、眼底检查、OCT和动眼神经功能检查。应鼓励使用VIS等评分系统,以便在不同的手术系列之间进行比较。
·应进行完整的术前和术后内分泌评估。
·Sebastien Froelich教授等强烈鼓励在报告手术系列的结果时使用分类,以便在不同的手术方法和不同系列之间进行比较。
·文献支持使用单侧入路。大多数作者的优选方法是在视力较差的一侧采用同侧手术。
·文献支持使用颅底入路,其基本原理是减少脑压板压迫,对肿瘤进行早期断流术,并对受累较多的视神经进行早期减压。外侧裂的广泛开放是不必要的。
·鉴于缺乏关于OCI发病率和模式的证据,常规硬膜外视神经管开放的选择仍需根据实践模式(取决于肿瘤的扩展)和外科医生的偏好来决定。
·文献支持在开始肿瘤切除前对视神经进行减压,这似乎与良好的视觉效果有关,或者至少在降低手术导致的视觉退化率方面。
·在大多数神经外科中心,经颅入路仍然是优选。通过鼻内途径进行的手术仍然局限于少数已知的EEA颅底中心。在某些病例中,由于肿瘤形态的限制和对视觉功能的优势,手术仍有局限性。
- 相关真实案例
- 点击联系我们
- 文章标题:威胁视力的鞍结节脑膜瘤手术争议释疑:INC国际教授携欧洲神经外科协会多方位梳理!
- 更新时间:2022-03-09 09:51:53