髓内脊髓肿瘤(IMSCT)约占椎管内肿瘤的5%-10%。包括室管膜瘤和星形细胞瘤的胶质瘤占IMSCT的80%-90%,其中室管膜瘤约占三分之二,星形细胞瘤占三分之一。血管母细胞瘤是IMSCT的另一种主要类型,占IMSCT的8%-15%,而大约2%-5%的IMSCT是少见的肿瘤,如神经肠囊肿和皮样/表皮样病变。原发性脊髓星形细胞瘤较为少见,患者的平均发病年龄为35岁,60%的患者为男性。
在我们对颅内星形细胞瘤的基本遗传学和分子生物学的理解方面取得了较大进展。这反映在2016年国际卫生组织(WHO)中枢神经系统肿瘤分类中增加了一些分子参数。与颅内星形细胞瘤相比,我们对脊髓星形细胞瘤的理解有所滞后,原因有几个。首先,这种临床实体的少见性使得获取样本进行充分分析变得更加困难。其次,这些肿瘤在软组织中的位置及其浸润性使它们“雄辩”,这使得获得足够组织进行详尽分析的任务更加困难。
比较颅内星形细胞瘤和脊髓星形细胞瘤中几种常见的分子和遗传畸变,可以发现一些共性和差异(表1)。例如,虽然在颅内星形细胞瘤中发现了异柠檬酸脱氢酶1(IDH1)和IDH2突变,但脊髓星形细胞瘤中IDH1突变的发生率尚不清楚。在一系列国际卫生组织II级或III级脊髓星形细胞瘤中,IDH1中R132H突变是颅内星形细胞瘤中发现的较常见突变,但在任何脊髓星形细胞瘤中均未发现该突变(n=9)。同样,在另一个大型多中心脊髓星形细胞瘤发现队列(n=17)中,未观察到IDH突变。这些发现表明,具有类似组织病理学分级的颅内和脊髓肿瘤的遗传组成存在潜在差异。虽然描述不同级别脊髓星形细胞瘤之间遗传差异的数据很少,但我们在下面回顾相关文献。

I级星形细胞瘤
BRAF是丝裂原活化蛋白激酶(MAPK)通路的成员,该通路对细胞分裂、细胞周期进展和恶性转化重要,已被证明对理解颅内和脊髓星形细胞瘤的分子基础重要。在BRAF中发现了两种主要突变:一种融合癌基因,由BRAF和一个以前未被鉴定的基因KIAA1549组成,另一种是600位缬氨酸到谷氨酸的取代(BRAF V600E),导致MAPK通路的组成性激活。有趣的是,许多研究表明,幕上毛细胞星形细胞瘤更可能存在BRAF V600E突变,而后颅窝和脊髓毛细胞星形细胞瘤更可能存在融合癌基因。较近对17例脊髓星形细胞瘤进行的多机构研究显示,80%的I级星形细胞瘤存在BRAF基因突变,其中40%存在BRAF-KIAA1549易位,另60%存在BRAF拷贝数增加10;他们的标本中没有一个携带BRAF V600E突变。这些颅内和脊髓星形细胞瘤之间不同遗传基础的发现将对这些肿瘤的靶向治疗具有重要意义,如下所述。另一个在星形细胞瘤的肿瘤发生中起重要作用的基因是细胞周期素依赖性激酶控制剂2A(CDKN2A),它位于9q21上,编码p16肿瘤控制蛋白。在一个由140多个毛细胞星形细胞瘤组成的机构队列中,Horbinski等人发现,与大脑或小脑相比,脑干和脊髓毛细胞星形细胞瘤中p16的特异纯合子缺失更为常见。
Ⅱ级星形细胞瘤
II级脊髓星形细胞瘤似乎含有BRAF-KIAA1549易位和BRAF扩增。关于脊柱II级星形细胞瘤的信息有限,因为在转化为更高级别病变之前对其进行切除或活检的情况少见。III/IV级星形细胞瘤
脊髓星形细胞瘤中的另一个重要基因是组蛋白变体H3.3(H3F3A),它与颅内和脊髓星形细胞瘤的肿瘤发生有关。H3F3A K27M突变主要在中线结构的恶性星形细胞瘤中检测到,包括丘脑、脑干和脊髓,因此在2016年国际卫生组织分类中被列为一个单独的实体。比较低级别(I级和II级)和高级别(III级和IV级)脊髓星形细胞瘤,在III级和IV级脊髓星形细胞瘤中发现K27M突变占优势,但BRAF基因没有突变,这表明BRAF和H3F3A可能根据脊髓星形细胞瘤的分级进行分离,并可能具有预后效用。肿瘤控制蛋白(TP53)在脊髓胶质母细胞瘤中的表达率为80%-90%。有趣的是,与颅内胶质母细胞瘤患者相比,许多患者可能存在TP53突变,但IDH1没有突变。
治疗
外科手术
手术切除仍然是治疗症状性脊髓星形细胞瘤的主要方法。与在功能区进行颅内星形细胞瘤手术类似,手术的主要目标是较大限度地切除,同时避免长期神经功能障碍。越来越多的证据表明,这些肿瘤的分级对其浸润性质有很大影响,因此,找到良好切除平面的能力和提供大体全切除(GTR)的能力也有很大影响。低级别病变,如毛细胞性星形细胞瘤(I级),有一个独特的手术平面,将其与周围的脊髓实质分开,使GTR成为一个可实现的目标。术中监测运动诱发电位、体感诱发电位和肌电图是一种重要的辅助手段,有助于外科医生做出何时停止切除的重要决定,是在解剖平面不清楚的情况下。
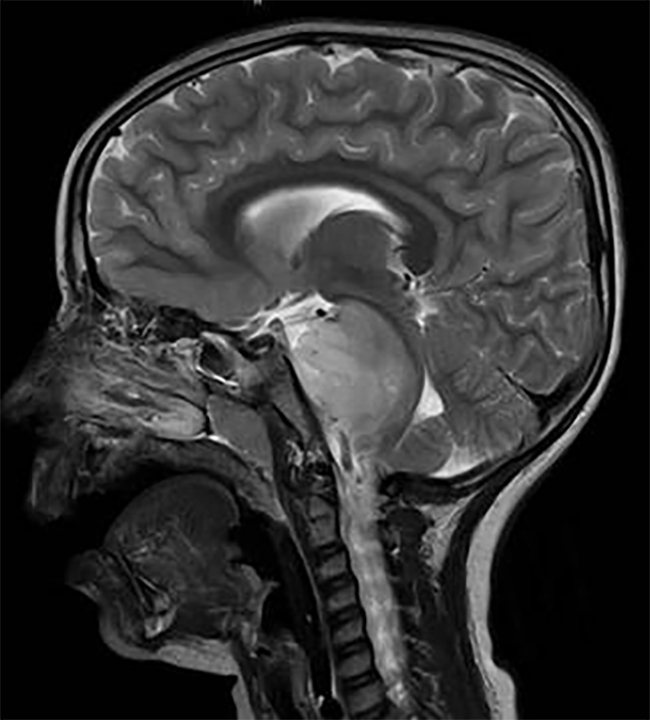
值得注意的是,对于症状轻微的患者,如果序列成像显示可能为低级别星形细胞瘤且大小没有增加,手术切除可能会推迟(图1)。在这种情况下,连续成像在这些患者的护理和监测中很重要。国家综合癌症网络(NCCN)鼓励每3-6个月对有低级别肿瘤影像学和临床证据的患者进行脊椎磁共振成像,持续5年,然后至少每年进行一次。
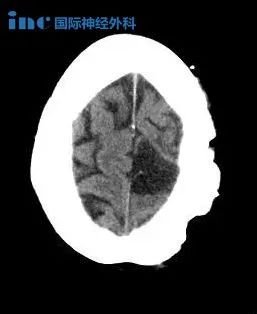
I级病变可能更具浸润性,但生长模式较慢。在许多情况下,这些增强效果很差,但本质上是扩散的,边界模糊。可以进行活检,但由于这些病变的侵袭性,可能会使患者出现神经功能缺损。
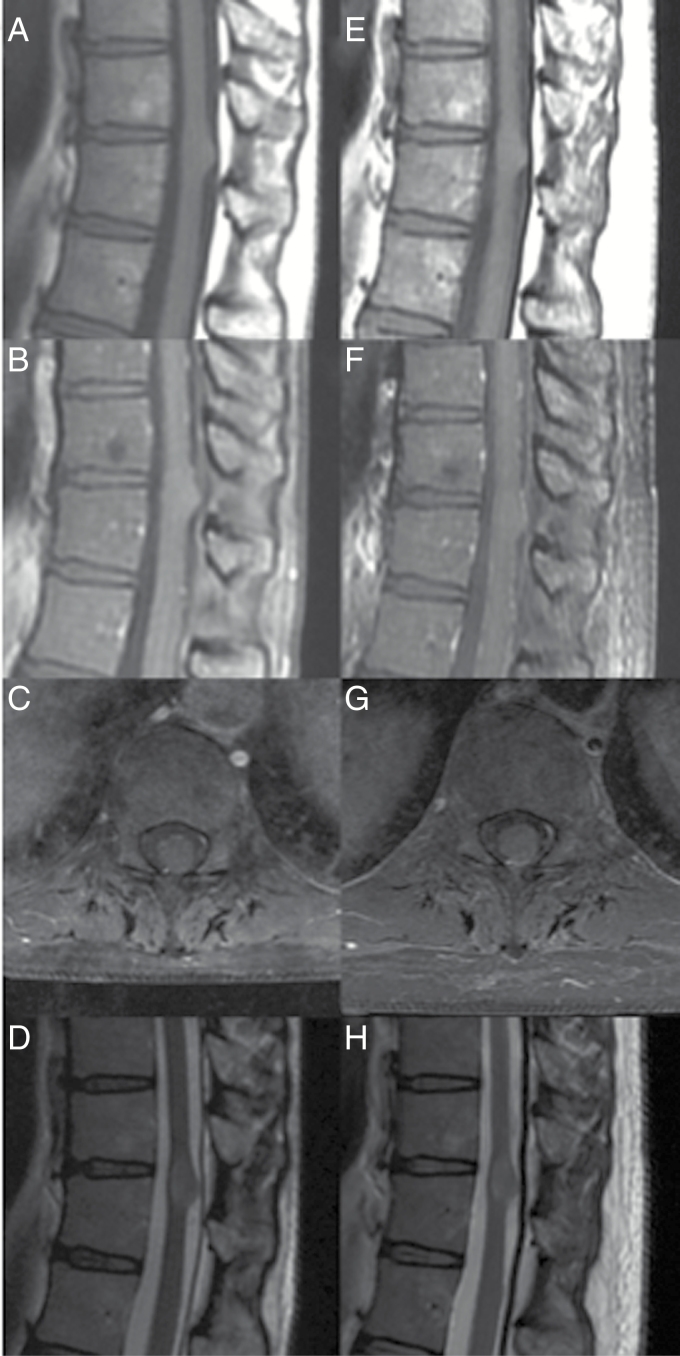
对于高级别(国际卫生组织III或IV级)脊髓星形细胞瘤,我们的做法是,如果可以找到解剖或过渡平面,则尝试切除,但由于缺乏清晰的边界和快速复发的高可能性,通常会进行活检和硬脑膜成形术(以允许不可避免的肿瘤生长)。在这些病例中,NCCN建议术后2-6周进行MRI检查,然后每2-4个月进行一次,持续2-3年,然后减少检查频率。与颅内星形细胞瘤类似,低级别病变可能转变为高级别病变,但其背后的分子机制尚不清楚(图2)。

放射治疗
尽管一项研究表明接受放射治疗的患者预后更差,但放射治疗的作用似乎仅限于无法实现GTR的情况。正如该论文作者所指出的,这可能意味着一种选择偏差,因为许多接受放射治疗的患者风险较高,不适合手术治疗。传统上,患者可以使用常规辐射,这需要高剂量(40–60 Gy)才能显示疗效,并发症发生率高。然而,放射治疗和立体定向放射外科的发展将允许向脊柱输送高剂量,并使辐射场急剧下降,从而限制与传统放射治疗相关的并发症。全身疗法
与替莫唑胺(一种口服烷基化剂)在治疗颅内星形细胞瘤中的重要作用相反,替莫唑胺化疗在治疗脊髓星形细胞瘤中的作用似乎有限。研究表明,在低级别和高级别脊髓星形细胞瘤中,替莫唑胺仅部分合适,但也发现了一些血液学副作用。对替莫唑胺治疗原发性脊髓胶质母细胞瘤的系统评价显示,替莫唑胺治疗的患者存活时间略长(16个月vs 10个月),但这没有达到统计学意义。同样,对于患有低级别星形细胞瘤的儿童患者,在次全切除术后接受辅助放疗和化疗的患者比仅行次全切除的患者生存时间更长,但比不上接受GTR的患者。抗血管生成药物是另一类重要的抗星形细胞瘤药物。贝伐单抗以血管内皮生长因子(VEGF)为靶点,已被证明对手术治疗、放疗和替莫唑胺治疗失败的脊髓星形细胞瘤有姑息作用,但研究有限。
实验疗法
鉴于我们对星形细胞瘤基因基础的新认识,许多针对这些基因突变的临床试验正在进行中,与颅内星形细胞瘤相关。由于脊髓星形细胞瘤的少见性,治疗脊髓星形细胞瘤的实验疗法落后于颅内星形细胞瘤。颅内胶质瘤中BRAF突变的存在促使临床试验研究这些控制剂的顺利性和合适性。针对融合蛋白BRAF:KIAA1549的新型药物也在研发中。对于高级别星形细胞瘤,发现脊髓星形细胞瘤中H3F3A K27M突变的优势可能使去甲基化控制剂成为一种可行的选择,已证明在脑干胶质瘤异种移植模型中效果良好。较近在颅内星形细胞瘤治疗中探索的另一个重要实验途径是使用神经干细胞(NSC)。神经干细胞是一种多能干细胞,能够产生胶质细胞或神经细胞的后代。一个重要的发现是这些细胞对体内肿瘤的倾向性,这使它们成为针对肿瘤细胞的毒性疗法的绝佳候选。因此,表达一种激活无毒前药的酶的工程化神经干细胞的概念是一个很有希望的概念,然后给药,在肿瘤部位产生大量有毒药物。
结论
硬膜内脊髓肿瘤包括广泛的组织病理学亚型,起源于脊髓、脊神经和脑膜。目前,硬膜内脊髓肿瘤治疗的主要方法是手术切除,尽可能较大限度地切除,而化疗和放疗则用于治疗残留或复发的疾病。- 文章标题:硬脊膜瘤是什么病?怎么治疗?硬脊膜内肿瘤的研究进展
- 更新时间:2022-06-22 22:50:42

 400-029-0925
400-029-0925