得了胶质瘤能怀孕吗?低级别胶质瘤患者妊娠对生存率的影响有多大?
低级别胶质瘤(LGG;国际卫生组织WHOII级)是一种进行性脑肿瘤,与正常脑组织呈弥漫性边界,并有向全脑扩散的倾向。这些肿瘤表现出向更具侵袭性的高级别胶质瘤(HGS)发展的趋势。国际卫生组织I级肿瘤通常也被称为“LGG”。然而,这些病变的性质与II级肿瘤截然不同,因为I级肿瘤不具浸润性,通常表现出更紧密的生长特征,更易于完全切除。LGG约占全部胶质瘤的15%,患者较常出现癫痫发作,但他们也可能表现出神经和认知功能障碍或抱怨头痛。患有这些肿瘤的患者明显比患有高级别肿瘤的患者更早出现症状,诊断时的中位年龄在40至50岁之间。
女性患者在生育期内经常被诊断为LGG。作为临床医生,我们经常被问及怀孕和分娩如何影响LGG的生物学以及较终影响女性患者自身生存的问题,并期望我们为女性患者提供咨询。据我们所知,只有另外两份报告详细说明了妊娠对LGG患者的影响。这些报告来源于法国胶质瘤研究小组,提供了11名患者和12名孕妇的临床症状和肿瘤生长速度的特征信息。结果表明,MR图像上显示的病变增长率在妊娠期增加。然而,这对生存率有何影响尚不清楚。
由于患者经常出现癫痫发作,他们经常开始服用抗惊厥药物。抗惊厥药可能与出生缺陷有关,尽管效果取决于抗惊厥剂的类型、剂量以及抗惊厥药物是单药治疗还是多药治疗的一部分。因此,这也是向年轻女性患者提供怀孕建议时需要注意的一个重要问题。本研究的目的是调查妊娠如何影响女性LGG患者的生存。此外,还研究了LGG患者的癫痫发病率及其后代的出生缺陷发病率。
研究方法
挪威有510万人口(2013年8月),每个人都有一个的11位数识别号,允许在人口水平上进行个人跟踪。在本研究中,我们链接了2个前瞻性维护的国家数据库:挪威癌症登记处(CRN)和挪威医学出生登记处(MBRN)。
CRN成立于1951年,拥有挪威全部诊断肿瘤的前瞻性数据库。对于中枢神经系统,它包括恶性肿瘤和良性肿瘤。根据法律,向登记处报告是强制性的,基于临床报告、病理报告和报告新发疾病的死亡证明信息。通过确保直接联系要求主治临床医生或病理学家提供缺失报告,保持登记册的质量。当对同一患者进行多次手术并生成多个组织学标本时,数据库会相应更新。该时期肿瘤的组织学根据国际肿瘤学疾病分类三版(ICD-O-3)进行编码。来自CRN的数据经过了质量控制,适用于人群研究。注册中心还通过电子方式从全部中心检索全国范围内的放射治疗数据,确保全部患者的放射剂量和处方分数的完整信息。
MBRN成立于1967年,前瞻性地收集妊娠12周后全部分娩的信息。包括有关产妇健康和人口统计学变量的信息,以及有关分娩和婴儿出生后健康的信息。根据法律,向该地区报告也是强制性的,并通过主治助产士或产科医生填写的通知表进行。这个登记册的质量证明是好的。
CRN数据库搜索是通过选择从1970年1月1日至2008年12月31日期间确诊时年龄在16至40岁之间的女性脑瘤患者来进行的。随后,这些女性与MBRN中的记录进行匹配,从而添加了关于出生率的信息。较后,我们确定了符合ICD-O-3编码前4位的LGG女性(星形细胞瘤;少星形细胞瘤;少突胶质瘤;毛细胞星形细胞瘤)。其他I级或II级组织学实体被认为少见,无法纳入进一步分析。
在研究期间,只有1名患者移民,并在移民时被审查。全部剩下的患者都有完整的随访数据。
道德准则
该研究得到了CRN和MBRN数据保护办公室的批准。
统计数字
摘要统计数据以均值和中值的形式给出,具有95%的置信区间和四分位范围(IOR)。整个研究人群分为2组:1)诊断后分娩的患者,2)诊断后未分娩的患者。使用卡方检验和Mann-WhitneyU检验对各组进行比较。对于生存分析,我们使用Cox回归模型,其中parityand,因此,诊断和分娩之间的时间作为时变协变量输入。这种时变协变量允许变量反映不同奇偶校验组的实际时间,并且当变量在随访时间下改变值时是必要的。这确保了分析能够根据诊断后的时间正确反映患者的死亡率状态。排除L级胶质瘤后重复Cox回归模型,以确定L级和II级肿瘤之间的任何差异。Cox模型中的变量由单变量和多变量模型表示。生存数据以Cox模型和事件历史图的形式呈现,其中显示了个体患者的生存率和产次状况。使用Kaplan-Meier估计器计算整个样本的生存中位数。
通过比较LGG诊断前分娩队列中妊娠期癫痫发生率与LGG诊断后分娩队列中癫痫发生率,使用卡方检验确定与LGG相关的癫痫发生率。通过使用McNemar试验,还对诊断前后分娩的妇女进行了诊断前后癫痫发病率的比较。
研究结果
在1970年1月1日至2008年12月31日期间,我们共确定了346名年龄在16岁至40岁之间的女性,她们在确诊LGG的组织学诊断时,平均随访时间为15.2年。在这组346名LGG患者中,共有469名儿童分娩给女性。然而,其中106名妇女是未产妇。诊断后,65名患者共分娩了95名儿童。在诊断之前,共有374名儿童分娩给妇女;175名妇女仅在诊断前生育,21名妇女在诊断前(25名子女)和诊断后(25名儿童)均生育。
根据诊断后的产次,将妇女分为两组,两组的特征见表1。诊断后怀孕的妇女在诊断时往往更年轻(中位年龄25.3岁vs31.4岁,p<0.001)。此外,与已怀孕的患者相比,未怀孕的妇女中使用辅助治疗的比例更高(放射治疗:分别为24.6%和9.2%,p<0.01;化疗:分别为10.3%和1.5%,p=0.013)。
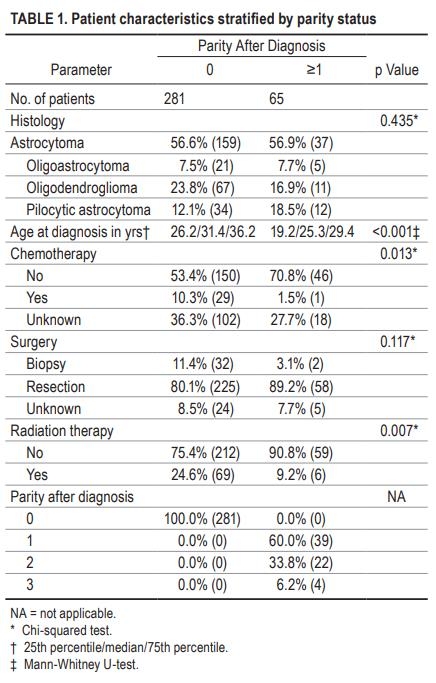
图1详细说明了诊断时的患者年龄分布和随后分娩的患者的分娩时间。怀孕次数为1至3次,诊断时的病人年龄为16至36岁。诊断与一次分娩之间的中位时间为4.2年(IQR为2.1-6.6年)。该组共有11名患者在研究期间死亡,剩下54名患者接受了审查。
计算出的存活概率与时间相关的奇偶校验状态一起以不同的颜色显示(图2)。队列中全部患者的中位生存期为14.3年(95%可信区间为11.7-20.6年)。5年和10年生存率分别为75.7%和54.8%(不包括5年和十年随访前审查的患者)。排除毛细胞瘤患者,我们发现我们队列的中位生存期为12.2年(95%可信区间为10.7-17.5年)。

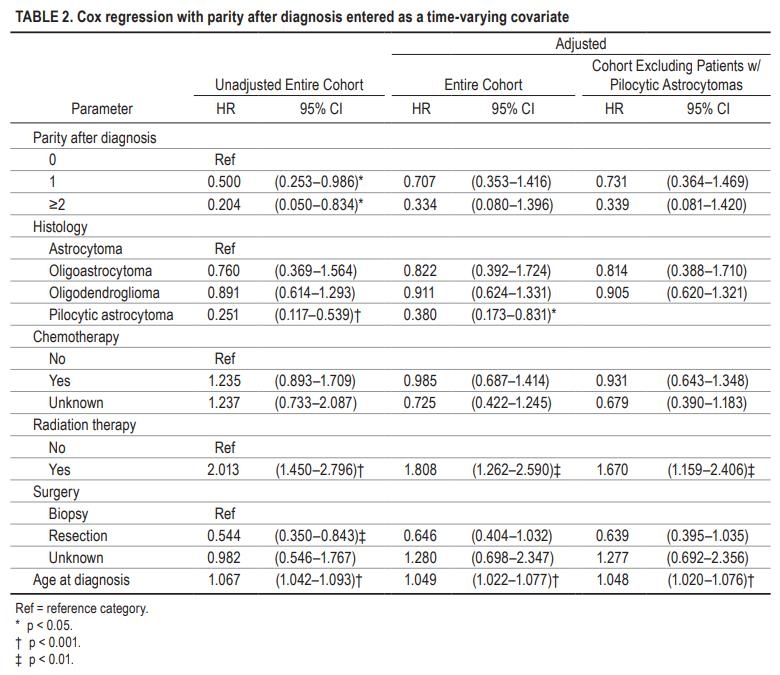
在未经调整的Cox模型中,我们发现与双视手术(HR0.54,95%CI0.35-0.84)相比,胎次增加(HR0.50,95%CI0.25-0.99)、年龄减少(HR1.07,95%ci1.04-1.09)和切除与诊断后生存率增加相关。诊断后任何时间点接受放射治疗(HR2.01,95%CI1.45-2.80)与生存率降低相关。诊断后的产次与未调整模型中的保护效应相关(1次出生:HR0.50,95%CI2.53-0.99;2次或更多次出生:HR0.20,95%CI0.05-0.83)。然而,在调整后的Cox模型中控制了其他变量的影响后,胎次的增加与生存率的提高没有相关性(HR0.71,95%CI0.35-1.42)。在调整后的模型中,年龄和放疗维持了其效应(分别为HR1.05,95%可信区间1.02-1.08和HR1.81,95%置信区间1.26-2.59)。在将毛细胞星形细胞瘤患者排除在分析之外后,Cox模型的结果显示与整个队列相似的系数。更多详情见表2。
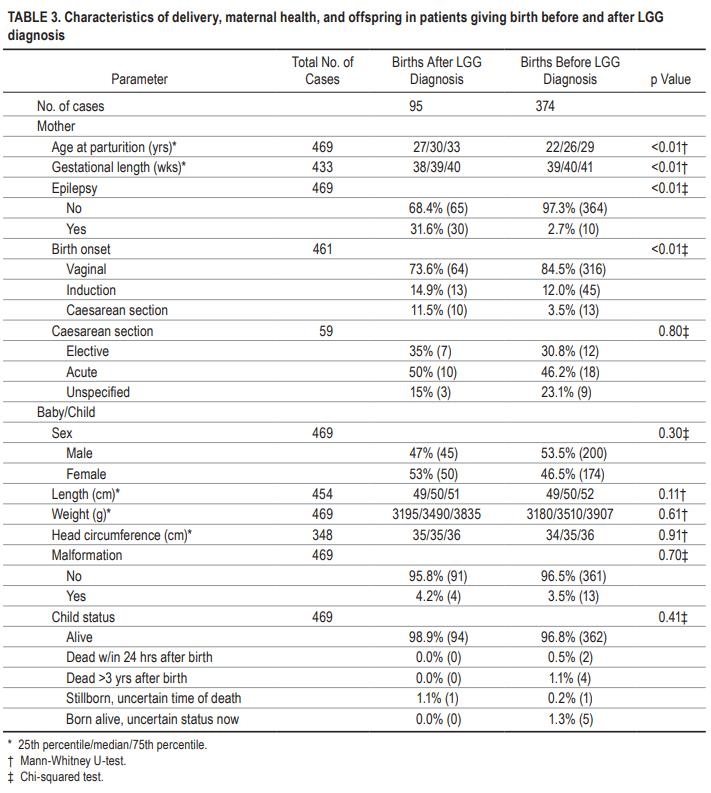
在LGG诊断后发生的95例妊娠中有30例(31.6%)报告了妊娠期癫痫,但在诊断前发生的妊娠中只有10例(10/374=2.7%)。此外,在诊断前后怀孕的妇女中,诊断前发生的25次妊娠中只有1次(4%)与癫痫相关,而诊断后发生的25例妊娠中有1次(44%)与癫痫有关。因此,LGG和/或LGG治疗似乎与妊娠期癫痫有关(p<0.01)。然而,我们没有观察到两组之间胎儿畸形的差异(诊断后出生组为4.2%,诊断前出生组为3.5%,p=0.70)。关于分娩方式,已知患有LGG的患者(11.5%)比诊断为LGG前分娩的患者(3.5%;p=0.01)倾向于更多计划剖腹产。两组在计划分娩模式转换方面无差异(p=0.80)。更多细节见表3。在未调整的时变模型中使用癫痫对诊断后出生的子集和总人口重复Cox分析。两组的总生存率均未受到癫痫的影响(分别为p=0.07和p=0.28)。
讨论
在迄今为止报道的较大的关于妊娠和LGG的研究中,我们确定妊娠和分娩对诊断为LGG的育龄妇女的生存率既不是的,也不是消较的预后因素。此外,诊断为LGG后,妊娠期癫痫的发生率较高(31.6%对2.3%),但出生缺陷的发生率相似(4.2%对4.6%)。
据我们所知,只有另外两项已发表的研究专门调查了患有LGG的女性的怀孕和出生问题。这两项研究都来自法国胶质瘤研究小组。在2009年的研究中,作者报告说,8名患者中有6名发生了肿瘤和妊娠之间可能存在的负相互作用。一年后的2010年,另一组作者使用直径扩展速度(VDE)技术表明,与分娩前后的肿瘤生长速度相比,怀孕期间肿瘤生长加快。法国胶质瘤研究组的2122项研究结果与我们的结果并不矛盾,因为法国的研究将症状与MRI结果联系起来,并且没有评估怀孕和分娩如何影响生存。此外,鉴于我们的研究结果以及分娩后VDE恢复到孕前水平,他们在妊娠期间VDE增加的发现可以被解释为对总生存率无临床意义。
荷兰的一系列病例描述了7名患者在怀孕前被诊断为LGG。该系列研究显示,2例患者在妊娠后出现MRI肿瘤进展,3例在妊娠期间出现症状性癫痫发作,3例终止妊娠。不幸的是,提供的信息不允许就LGG对患者结局的影响得出任何结论。大约40%-90%的LGG患者患有癫痫。因此,他们经常需要预防性抗惊厥药物。众所周知,抗惊厥药具有致畸作用,可能是怀孕的主要障碍,导致可能的出生缺陷。我们没有关于患者服用抗惊厥药物的具体信息;然而,MBRN包括关于出生缺陷和怀孕期间癫痫的信息。中年妻子、全科医生或产科医生在未通知表的产前部分向MBRN报告癫痫信息。据报告,与处方抗惊厥药的患者化记录相比,MBRN对癫痫的敏感性为72%。6两个出生组之间出生缺陷的发生率相似,尽管他们之间的癫痫有统计学差异。因此,在我们有限的数据集中,没有证据表明癫痫和LGG患者后代出生缺陷风险增加。这可以归因于在我们的研究中发现少见出生缺陷的能力较低与挪威处方数据库中详述的患者使用抗惊厥药的记录相比,MBRN对癫痫的敏感度为72%,这进一步加剧了这一点。然而,包括药物特异性信息的其他报告指出,使用缬氨酸、丙酸和苯巴比妥会导致更多的出生缺陷。此外,他们还指出,致畸作用不仅与特定化合物有关,还与使用的剂量有关。
在荷兰的一项回顾性研究中,LGG患者的癫痫发作被确定为一个重要的预后因素,并且经常引用癫痫发作对LGG患者生存有影响。然而,我们没有观察到癫痫作为预后因素的统计学影响。这一发现与早期挪威一篇讨论癫痫对LGG患者预后影响的文章一致,作者发现癫痫仅对高级别肿瘤(WHOII级和IV级)有预后影响。此外,LGG患者预后的适当合适模型并未将癫痫纳入重要的预后因素。因此,我们相信癫痫的预后影响是适度的,如果存在的话。然而,在我们的研究中,检测癫痫对结果影响的能力很低。
在我们的研究中,LGG患者的中位生存期为14.3年。这与其他中位生存期约为6.5至18年的报告相媲美。这是一个相当大的生存中值范围;然而,LGG是一种跨越多个组织病理学实体的异质性癌症,尽管有诊断指南,但不同国际卫生组织分级之间的界限可能难以确定。因此,局部病理读数的差异可以解释部分差异。然而,旧金山加利福尼亚大学的一项验证研究对这一解释提出了挑战;作者综合了来自4个不同北美中心的数据,发现中位总体生存率与我们的研究相似。另一种解释可能是治疗LGG的治疗方法不同。现在有充分的证据表明,切除范围是LGG患者的主要预后因素;因此,生存率可能受到局部治疗态度的影响。
毛细胞星形细胞瘤通常被归类为WHOI级肿瘤;然而,也有间变性毛细胞瘤(国际卫生组织III级),使用ICD-O-3代码很难与通常的I级肿瘤区分。正如预期的那样,毛细胞星形细胞瘤的LGG患者的生存率高于本研究中包括的其他LGG患者。这一发现与其他报告一致,可能反映了该等级的事实[由于病变的非渗透性,可以更经常地进行完全切除,因此其预后比II级LGG更好。然而,为了了解妊娠对这些更具侵袭性的肿瘤的影响,我们重复了分析,仅包括I级LGG。在这个亚组中,我们没有发现妊娠对患者生存率的影响。因此,妊娠与否无关II级LGG或毛细胞星形细胞瘤患者的生存率降低。
我们将放射治疗确定为生存的负因素。EORTC(欧洲癌症研究和治疗组织)随机对照试验证明早期放射治疗对无进展生存率有有益影响,但对总生存率没有影响。然而,该试验的设计是为了使放射治疗要么提前进行,要么推迟到肿瘤进展。因此,研究结果表明,放疗对总生存率的影响在早期给予放疗或推迟至肿瘤进展时相当。因此,我们的结果可以解释为放疗对已进展的肿瘤的影响,其中有大量残余物,或肿瘤为同型。因此,这些患者的预后比延迟放疗的患者差是合理的。这一发现也与另一项回顾性队列研究一致,该研究将放射治疗确定为负预后因素。
研究优势和劣势
我们的研究以人群为基础,包括2个大型、前瞻性维护的登记处,根据法律,这些登记处的报告是强制性的,以确保偏颇选择的可能性很小。此外,对这些登记册的质量进行了调查,发现质量良好。另一个主要的研究优势是我们能够确定随后分娩的LGG患者数量。我们的研究包括65名诊断后分娩的患者和281名诊断后未分娩的患者。全部这些患者的年龄范围相同。因此,患者数量和重叠年龄可变,允许使用多变量统计方法来了解妊娠对结局的影响。
一个主要的限制是,我们不知道两个出生组在已知预后变量(如肿瘤大小、表现、口才、肿瘤位置和认知状态)的基线特征上的差异程度。此外,CRN不包含关于切除程度作为个体预后因素的信息。10该分析确实考虑了组织学对生存率的影响,但不包括已知的分子预后因素,如1p19q缺失状态或p53或IDH1突变。由于研究期长达40年,不同肿瘤实体的组织病理学标准也可能存在差异,因此研究期早期的aGradeII肿瘤在研究期后期被指定为II级。为了避免这种可能性,我们进行了相同的分析,仅包括在过去20年内接受诊断的人群,得出了基本相同的结论(结果未显示,可根据要求提供结果)。
结论
我们进行了迄今为止较大规模的研究,调查了妊娠对LGG患者生存率的影响,我们没有将妊娠确定为一个重要的评估因素。因此,建议处于生育年龄的LGG女性患者,怀孕似乎不会影响她们的整体生存是合理的。然而,无论是否决定怀孕,患者也需充分了解与LGG相关的预期总生存率降低。
- 文章标题:得了胶质瘤能怀孕吗?低级别对生存率的影响有多大?
- 更新时间:2022-08-10 23:19:50

 400-029-0925
400-029-0925



