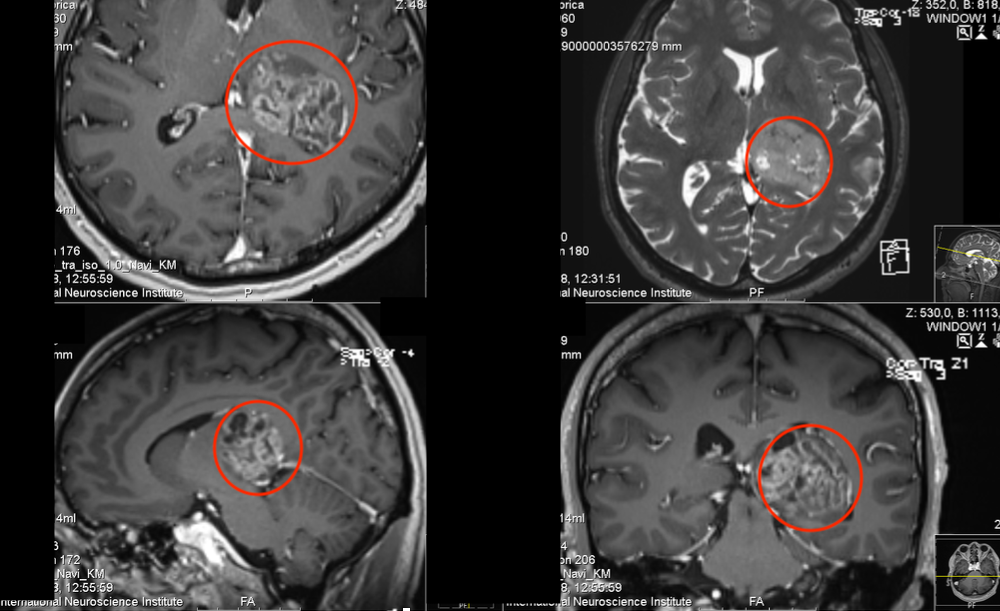
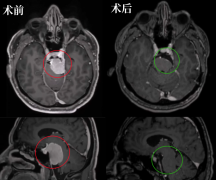
1VEGF信号通路
VEGF是诸多血管生成因子中作用较强、研究较广泛、作用较清楚的一个。VEGF是由两条单链蛋白通过二硫键构成的34~46KD的分泌蛋白。VEGF家族目前有7个成员,分别是VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGFF及胎盘生长因子(PIGF),其中VEGF-A在多种组织器官中表达,也是促进肿瘤血管生成的重要因子。VEGF-A外显子的变位剪切可以产生多种单体,即VEGF121、VEGF145、VEGF148、VEGF183、VEGF165、VEGF189、VEGF206。VEGF作为分泌蛋白,与细胞膜上相应的受体(VEGFR)结合后发挥相应的生物学功能。VEGFR主要包括三个成员:VEGFR-1(Flt-1)、VEGFR-2(KDR/Flk-1)和VEGFR-3(Flt-4)。

VEGFR是跨膜的酪氨酸蛋白激酶,其胞外段含有7个Ig样结构域,胞质段含有酪氨酸激酶结构域。当VEGF与VEGFR结合后导致其构象发生变化,使其胞内的酪氨酸激酶区域发生自磷酸化,从而进一步激活下游信号通路。VEGF/VEGFR可以促进血管内皮细胞的增殖、浸润和迁移,提高血管壁通透性,促进血管支持物的形成,控制细胞凋亡等,是刺激血管生成较强的细胞因子,在血管生成中起着关键作用。
研究表明,VEGF及其受体在多种肿瘤组织中均有异常表达,与肿瘤的发生发展及预后密切相关。在胶质瘤中,VEGF及VEGFR的蛋白和mRNA表达水平也明显升高,而且随着胶质瘤的恶性程度增加,表达水平越高,患者的预后越差,提示VEGF/VEGFR信号通路在胶质瘤发生发展及预后中起着重要作用。阻断VEGF/VEGFR信号通路可控制肿瘤血管的生成,发挥抗肿瘤作用,目前临床已有多种针对VEGF信号通路的抗血管生成药物,以VEGF及VEGFR的抗体和酪氨酸激酶控制剂为主。
1.1靶向VEGF/VEGFR的抗体
①贝伐单抗(bevacizumab,avastin)是主要针对VEGF-A的高亲和力人源化单克隆抗体,也是美国食品药品监督局(FDA)批准的一个针对肿瘤血管生成的治疗药物。该药物可与VEGF特异性结合,阻断VEGF与VEGFR的结合,控制VEGF信号通路阻止肿瘤血管生成。有研究表明贝伐单抗联合化疗治疗复发性胶质瘤患者可好转其无进展生存期,并减少激素用量,但不能延长总生存期,并且容易对贝伐单抗产生耐药。美国FDA现已批准其用于复发性胶质瘤的治疗,成为胶质瘤抗血管生成药物的先锋代表。
②阿柏西普(ziv-aflibercept,zaltrap)是一种重组的融合蛋白,可与VEGF-A、VEGF-B、PIGF结合从而降低血管通透性和新生血管形成。阿柏西普在多项临床研究中已证实具有良好的耐受性和的抗肿瘤活性。目前针对复发性恶性胶质瘤的Ⅱ期临床试验也显示出的效果。
1.2靶向VEGFR的酪氨酸激酶控制剂
控制VEGFR酪氨酸激酶活性的小分子控制剂特异性不强,往往可以同时结合其他受体家族,被称为多靶点激酶控制剂。这些控制剂进入细胞内可与相应的靶分子结合,控制下游分子的磷酸化,阻断信号传导,从而控制血管生成。目前用于肿瘤治疗的主要包括西地尼布(cediranib,AZD2171)、舒尼替尼(sunitinib)、瑞戈非尼(regorafenib)、阿帕替尼(apatinib、)、索拉非尼(sorafenib)等。其中舒尼替尼是一种多靶点受体酪氨酸激酶控制剂,具有控制肿瘤血管生成和肿瘤细胞生长的作用,研究表明舒尼替尼联合放射治疗在复发的高级别胶质瘤患者中取得了较好的6个月无病生存期,患者对其毒副作用也可耐受。
也有研究表明虽然儿童患者对舒尼替尼有较好的耐受性,但该药物在这些患者中并未表现出明显的抗肿瘤活性。西地尼布是一种强VEGFR控制剂,研究表明西地尼布对复发性卵巢癌等有的抗肿瘤作用,但在治疗复发性胶质瘤时效果并不理想。多种酪氨酸激酶控制剂在其他肿瘤的临床研究中都具有的抗肿瘤活性,但在胶质瘤的治疗中临床效果往往较差。
2Ang/Tie2信号通路
促血管生成素(angiopoietin,Ang)及其酪氨酸激酶受体2(Tie2)与血管生成密切相关。促血管生成素-1(Ang-1)是一种分泌蛋白,可以促进内皮细胞的迁移、出芽及存活,并通过与受体Tie2结合使后者磷酸化,吸引血管平滑肌细胞等促进血管生成,介导血管重塑,维持血管结构的稳定。血管生成素-2(Ang-2)与Ang-1具有高度同源性,也可与Tie2结合,但不引起Tie2的磷酸化,因此可作为Ang-1的拮抗剂,竞争性控制Ang-1介导的信号传导,减少血管成熟,失去稳定性。
Ang/Tie2通路参与了多种肿瘤的血管生成过程,是Ang-2在肿瘤中表达水平明显升高,且可通过诱导产生内皮细胞蛋白酶、MMP-2等促进肿瘤的发展和转移。此外,研究发现Ang-2的作用与VEGF关系密切,VEGF的存在可以增加Ang-2的表达,协同Ang-2促进血管生成。通过分析TCGA胶质母细胞瘤数据库发现,Ang-2在胶质瘤的表达上调程度要明显高于Ang-1,表明胶质瘤中Tie2信号途径受到控制。在小鼠胶质瘤模型中,联合应用抗Ang-2和抗VEGF药物可以延长小鼠的生存期,减少血管的通透性,治疗效果优于单独使用抗VEGF药物,表明针对Ang-2的抗血管治疗可以克服胶质瘤对贝伐单抗的抵抗性。
此外,有研究发现Ang-2还参与了机体的免疫调节,针对Ang-2的抗血管生成治疗可募集活化T细胞进入肿瘤,使肿瘤更容易受到免疫攻击。目前针对Ang/Tie2信号通路的药物主要有:
①AMG386(Trebananib),一种重组肽-Fc融合蛋白,是Ang-1/Ang-2的中和肽体,可以阻断其与Tie2的结合,进而控制肿瘤血管生成。AMG386在临床试验中具有较好的耐受性,目前AMG386单独使用或联合贝伐单抗治疗复发性胶质瘤已进入Ⅰ/Ⅱ期临床试验。
②PF-04856884(CVX-060)是靶向Ang-2的连接IgG的特异性多肽,在动物模型中CVX-60联合VEGF通路控制剂可以控制肿瘤的转移。CVX-60在临床试验中也显示出较好的顺利性,已完成针对晚期实体瘤和肾细胞癌的临床试验,并开展了对复发性胶质瘤的相关临床研究。
③AMG-780和nesvacumab(REGN-910)分别是针对Ang-1/Ang-2的人源化单克隆抗体,目前已完成相应的Ⅰ期临床试验。由于Tie2也含有受体酪氨酸激酶结构域,因此控制酪氨酸蛋白激酶活性的小分子控制剂如瑞戈非尼等同样也可以控制此信号通路。
3MMPs
MMPs在血管生成中发挥重要作用。血管生成是从现有血管形成新血管的过程,需要降解血管基底膜并重建细胞外基质(extracellular matrix,ECM),以使内皮细胞迁移并侵入周围组织,而MMPs则是降解细胞外基质较重要的酶类,可以降解细胞外基质和基底膜中的胶原成分,促进内皮细胞迁移并参与ECM重建。血管生成贯穿了肿瘤生长、侵袭转移的整个过程,因此MMPs与肿瘤的发生发展密切相关。MMPs也参与了胶质瘤的侵袭转移,是MMP-2和MMP-9在胶质瘤中呈现出高表达,在其血管生成中发挥重要作用,与胶质瘤的发生发展、分级及预后均相关。
针对MMPs的控制剂在临床前研究中能够控制蛋白酶的活性,阻止肿瘤的进一步生长和转移,但此类抗血管生成药物在各期临床试验中大多都未达到预期效果,如一代合成控制剂巴马司他(BB-94),二代控制剂马马司他、坦诺司他等,均由于在临床试验中诱发明显的不良反应而终止临床研究。目前三代的MMPs控制剂MMI-166可以控制胶质瘤细胞的侵袭及血管生成,为胶质瘤的抗血管治疗带来了希望。
- 文章标题:抗胶质瘤血管生成的靶标
- 更新时间:2023-03-26 22:43:19

 400-029-0925
400-029-0925