胶质母细胞瘤(GBMs)是成人常见的原发性恶性胶质瘤。GBM患者预后不良,即使采用较大标准治疗,平均存活时间也只有14个月。结果不仅是由于本研究的渗透性的增长模式和存在的神经胶质瘤stemlike细胞(gsc),大多数细菌耐药治疗,也无法提供大多数治疗肿瘤,因为系统管理治疗由血脑屏障(BBB)或绝缘血肿障碍。为了克服这个传递问题,我们和其他人已经使用骨髓来源的麦肯希mal干细胞(MSCs)作为载体来传递抗胶质瘤制剂到GBMs,基于积累的证据表明骨髓间充质干细胞在局部和全身治疗后能够归巢到胶质瘤。骨髓间充质干细胞适合于实验和临床用途,因为它们可以很容易地从患者身上分离出来,在体外快速培养和扩展,并合适地进行工程设计,而且与其他干细胞相比,自体或异体移植的伦理学考虑更简单。

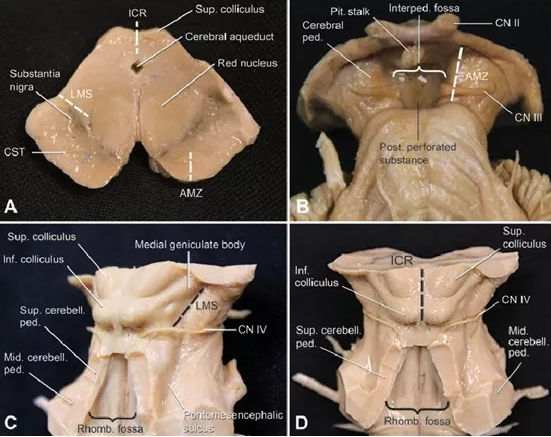
胶质瘤
我们已经证明,在血管内注射后,间充质干细胞选择性地定位于胶质瘤,这一特性已经在原位胶质瘤模型中被开发,以提供抗胶质瘤治疗,如干扰素-b, 30s - trail和溶瘤病毒。我们已经证明,间充质干细胞不仅可以用于从商业上可获得的小鼠或人类胶质瘤系生长的异种移植(例如,U87),而且还可以用于从人类GSCs获得的异种移植。这一发现很重要,因为商业细胞系不能模拟人类胶质瘤的几个关键特征,特别是浸润性生长模式,而GSCs则重现了临床所见的人类胶质瘤的基因型和表型特征。 GSCs具有自我更新能力,在培养中呈球状生长,即使植入少量细胞(1001000个细胞)也能在体内诱发肿瘤。另外,GSCs对大多数传统疗法具有耐药性,是肿瘤复发的主要细胞群。间充质干细胞是已知的组织损伤或炎症部位的宿主。因为肿瘤模拟的是不能愈合的伤口,我们推断骨髓间充质干细胞归巢到组织损伤部位的机制可能与骨髓间充质干细胞归巢到肿瘤的机制相似。在这种情况下,骨髓间充质干细胞在神经胶质瘤中对肿瘤衍生因子的反应与在未愈合的伤口中发现的类似。例如,我们发现间充质干细胞向生长因子(如血小板来源的生长因子(PDGF))、或炎症因子(如转化生长因子b1 (TGFb1))迁移。因此,我们假设,增强组织损伤和/或炎症的扰动,从而促进生长因子和趋化因子的释放,将增强MSC向胶质瘤的归位。这一假设与GSCs特别相关,因为我们之前报道过,一些GSCs是间充质干细胞强的吸引子(称为强吸引子,如GSC17),而其他GSCs在体内对间充质干细胞的吸引效率较低(称为弱吸引子,如GSC7-2)。因此,有必要开发临床适用的方法来增强MSC的归巢,特别是弱吸引子GSCs的归巢。电离辐射(IR)是一种能合适刺激肿瘤微环境中局部损伤或炎症的治疗方式。在辐射诱导损伤的反应中,肿瘤释放多种生长因子、趋化因子和细胞因子。
事实上,有报道显示,在小鼠乳腺癌模型中,放射治疗后骨髓间质干细胞的生物分布增强,至少部分原因是炎症细胞因子的增加。此外,辐射可以增强血管通透性,可能促进间充质干细胞从脑血管系统转移到肿瘤。在本研究中,我们验证了IR能够增强经血管内传递的间充质干细胞在胶质瘤中的定位的假设。我们使用商业上可用的人类胶质瘤细胞系(U87)和一些患者来源的GSC细胞系(GSC7-2, GSC11, GSC17)。随后,我们利用这些模型来识别肿瘤分泌的因子,并参与介导间充质干细胞向胶质瘤的转化。
参考文献:Doi:10.3171 / 2016.9.JNS16278
以上就是“电离辐射增强间充质干细胞的胶质瘤向性”的详细介绍。
- 文章标题:电离辐射增强间充质干细胞的胶质瘤向性
- 更新时间:2020-11-27 14:45:00

 400-029-0925
400-029-0925