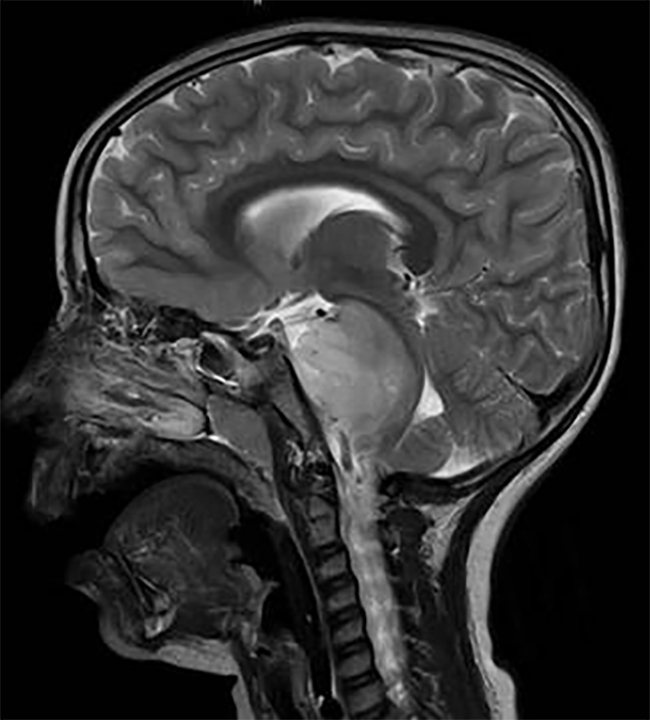
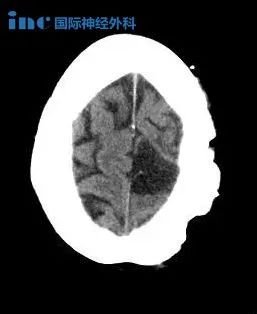
放射治疗在神经肿瘤学中起着关键作用,但与的、有时危及生命的神经毒性有关。新技术(如放射外科或近距离放射治疗)的发展扩大了放疗的适应症,包括更多良性疾病(如三叉神经痛或血管畸形),并增加了可能出现晚期毒性的长期幸存者的比例。因此,放疗的并发症引起了越来越多的关注。神经组织耐受性取决于几个目前定义明确的因素,如体积、总剂量、每部分剂量和照射持续时间。此外,可能增加放射性毒性风险的其他因素有年龄较大、并发疾病(如糖尿病、高血压)、血管疾病、辅助化疗以及可能的遗传倾向。放射治疗的不良神经影响通常根据与放射治疗相关的时间进程进行分类,包括急性疾病(数天至数周)、早期延迟并发症(1至6个月)和晚期延迟并发症(6个月以上) (表17-1)。辐射损伤可直接针对中枢或外周神经系统,或继发于血管或内分泌损伤或辐射诱发肿瘤的发展(图17-1)。

表17-1 放射治疗的主要神经并发症

图17-1 RT诱导神经毒性的病理生理学。逆转录病毒对中枢神经系统的损伤机制复杂,可能包括血管损伤、脱髓鞘和神经元损伤。血管损伤被认为是放射坏死中出现的异常血管、血栓和纤维蛋白样坏死的部分原因。RT还会导致少突胶质细胞耗竭,进而导致脱髓鞘和白质坏死。RT损伤的其他目标包括神经元、星形胶质细胞和小胶质细胞。
脑白质异常可能导致坏死的病理生理学尚不完全清楚,但已经提出了几个假说。因为组织学检查通常显示血管病变和脱髓鞘,血管和神经胶质细胞通常被认为是辐射损伤的主要目标(图17-1)。然而,情况可能更复杂:较近,辐射和其他细胞类型之间的相互作用以及中枢神经系统的再生能力得到了更密切的研究。下面将对放疗相关损伤的病理生理学的主要方面进行简短的讨论。
血管损伤
血脑屏障的短暂损害,可能是由鞘磷脂酶介导的内皮细胞凋亡引起的,被认为是导致急性或早期延迟类固醇反应形式的辐射毒性。血管理论也被提倡用来解释放射性坏死。坏死是继发于血管损伤的缺血的结果。在放射性坏死期间,血管损伤确实很突出,包括血栓形成、出血、纤维蛋白渗出、毛细血管扩张、血管纤维化/玻璃样变伴管腔狭窄和纤维蛋白样血管坏死。此外,进行性内皮细胞丧失和血管稀疏似乎先于白质坏死。因此,级联反应(包括信号分子等)可以在照射时开始,在整个临床静默期产生逐渐的细胞损失。在分子水平上,血管内皮生长因子似乎在内皮细胞丢失中起着关键作用。这种逐渐的丧失较终会导致明显的坏死。尽管有这些发现,但有几个观点反对纯粹的缺血模型:首先,神经元对缺血敏感,如果病变主要是血管性的,神经元应该受到损伤,而神经元实际上在放射性坏死期间基本上没有受到损伤。其次,血管损伤并不总是出现在放射性坏死中。其他细胞机制可能参与并维持血管损伤或导致脑中水肿、胶质增生和脱髓鞘,例如上调不同的粘附分子,细胞因子的产生,或者内皮细胞中累积的氧化应激。
少突胶质细胞
放疗后观察到的脱髓鞘病变强调了少突胶质细胞作为辐射损伤目标的假定作用。少突胶质细胞负责中枢神经系统髓鞘的产生,并来源于祖细胞,如2A氏细胞。中枢神经系统辐射诱导少突胶质细胞耗竭,并至少暂时控制少突胶质细胞祖细胞的产生,可能通过p53依赖的途径。然而,脱髓鞘在组织损害中的作用仍然值得怀疑,因为严重的脱髓鞘疾病如多发性硬化症不会导致明显的坏死。
其他中枢神经系统细胞类型
过去几年的几项研究集中在神经元、星形胶质细胞和小胶质细胞作为主要靶点或通过其调节能力的改变在辐射诱导损伤发展中的潜在作用。特别值得注意的是小胶质细胞的可能作用,这可能通过持续的氧化应激增强辐射损伤。年前就有报道称脑室下区受到辐射损伤,脑室下区是一个含有神经胶质细胞和神经干细胞的组织。较近的研究发现,在该区域照射后,室管膜下神经干细胞的减少呈剂量依赖性。因此,它们对辐射损伤的影响似乎是可能的,但仍有待阐明。
总的来说,辐射损伤的发展是复杂的,是血管细胞和少突胶质细胞以及神经干细胞之间相互作用以及这些细胞对损伤的生理反应的结果。由细胞因子和其他分子介导的广泛的细胞相互作用以及间接因素的影响,例如小胶质细胞的增殖或细胞损害导致的氧化产物的产生,可能是从一个患者到另一个患者观察到的多种损伤的原因。
- 文章标题:放射治疗的神经并发症
- 更新时间:2021-08-12 10:55:49

 400-029-0925
400-029-0925