良性的脑膜瘤,如何制定手术方案?
10.疑难脑膜瘤手术案例展示
脑膜瘤是临床中常见的肿瘤,从⼿术的⾓度考虑,脑膜瘤可⼤概分为四种:①凸⾯脑膜瘤;② 窦旁脑膜瘤;③镰旁及天幕区脑膜瘤;④颅底脑膜瘤。此外,也有⼀些少见部位的脑膜瘤,如脑室内脑膜瘤及脊髓脑膜瘤。不同种类 的脑膜瘤都有⾃⾝的特点,故需要不同的⼿术⼊路及⼿术策略。90%以上 的脑膜瘤是良性的,且有清楚的边界,所以通常可以完全切除。脑膜瘤主 要的⾎供来⾃其附着的脑膜,但某些⼤的脑膜瘤的⾎供亦可来⾃肿瘤周围的动脉。在能够避免过⾼致死致残率的前提下尽可能地全切肿 瘤。然⽽,对于颅底脑膜瘤,因肿瘤被颅神经包绕且可能侵犯静脉窦,切 除时⼀定要当⼼,且可能需要考虑⼿术之外的其他治疗⽅式。
图:不同位置的脑膜瘤
1.凸⾯脑膜瘤的⼿术策略
显微外科⾮常适⽤于凸⾯脑膜瘤的切除。⼿术的⽬标是全切肿瘤及肿 瘤基底处的硬膜,⽽且如果条件允许的话可切除⾄正常硬膜外1~2cm。为 此,锁孔⼊路并不适合凸⾯脑膜瘤的切除。开颅需要暴露肿瘤边界外⼏ 厘⽶才⾏。对于邻近颞部的凸⾯脑膜瘤,我们通常采⽤弧形切⼜,⽬的是 留取带蒂⾻膜⽚⽤于硬膜修补。沿⼿术切⼜局部注射⿇药可引起⽪下组织 ⽔肿,这有助于⾻膜的分离。并且,在⼿术开始时准备带蒂⾻膜⽚⽐在关 颅时准备要简单得多。⾻瓣的设计应充分暴露肿瘤及其基底。与其他⼊路 不同的是,在打开硬膜之前可先将硬膜悬吊于⾻窗周围,这样可以避免硬 膜外的渗⾎,甚⾄可以减少肿瘤切除时的出⾎。
后续的操作是切断来⾃硬膜的主要⾎供。环形切开肿瘤周围硬膜,切 开范围为肿瘤附着处外缘⼏厘⽶。我们通常选择在显微镜下切开硬膜,尤 其对于中线附近靠近上⽮状窦处的肿瘤。切开硬膜时应⼩⼼,避免损 伤邻近的动脉或静脉。同时需要指出的是,在剪开硬膜时我们要有⾜够的 耐⼼,因为这步完成后,肿瘤表⾯的许多⼩的出⾎便会⾃⾏停⽌。
硬脑膜切开后即可进⾏肿瘤切除。应逐步沿着肿瘤和⽪层之间的界⾯ 分离肿瘤。识别并保留过路动脉,电凝并切断供⾎动脉。肿瘤的形状决定 了它是整块切开还是分块切除。圆锥形的肿瘤通常可整块切除,⽽⼩基底 的球形肿瘤多需要分块切除,以避免过度牵拉肿瘤周围的脑组织。不过, 即使是球形肿瘤,也应在分块切除前尽可能多地切断肿瘤的供⾎动脉。切 开肿瘤往往伴随出⾎,⽽⽌⾎需要花费很长时间,这会减慢整个⼿术过 程。因此,凸⾯脑膜瘤的切除策略⾥很重要的是,仅在必要时才切开肿 瘤,⽽切开肿瘤的⽬的是分块切除并沿肿瘤边界分离⽽暴露更多的操作空 间。否则,我们均应严格沿肿瘤边界分离肿瘤。较近,我们⼤多成功保留 了肿瘤与⼤脑⽪层之间的⽪层静脉,这⽆疑缩短了病⼈的康复时间。其中 的诀窍是使⽤⾮常⾼倍的⼿术显微镜放⼤倍率,因为在⾼倍镜下很容易找 到肿瘤与脑组织间的界⾯,也很容易区分供⾎动脉和过路⾎管。肿瘤切除 后,肿瘤腔内严格⽌⾎,之后⾏硬脑膜修复。如果颅⾻未受肿瘤侵犯或仅 有轻度的⾻质增⽣,我们可⽤⾼速磨钻将⾻瓣内表⾯打磨后回纳⾻瓣。如 果颅⾻受到了肿瘤侵犯,则弃去⾻瓣,并以钛⽹、羟磷灰⽯或⾻⽔泥⾏颅 ⾻修补术。
2.⽮状窦旁脑膜瘤的⼿术策略
⽮状窦旁脑膜瘤源于⽪层硬脑膜,但它们靠近中线,有时可位于中线 两侧。它们与上⽮状窦和桥静脉关系不同,并常常侵犯后两者,所以在切 除的时候需要不同的考虑。通常情况下,在全部的凸⾯脑膜瘤当中,窦旁 脑膜瘤的切除较为困难,⽽且造成术后静脉窦阻塞的风险较⾼。
对于⽮状窦旁脑膜瘤,我们需要重点考虑两个问题:①如何切除它们 ⽽不损伤周围的桥静脉;②如何处理上⽮状窦旁肿瘤的侵犯⽽造成的上⽮ 状窦狭窄甚⾄闭塞等情况,需由术前的影像进⾏评估。静脉期CTA, MRA或DSA检查的图像可⽤于分析上⽮状窦是否通畅。如果术前上⽮状窦 已经闭塞,我们可能会决定全切肿瘤并扩⼤硬脑膜切除范围,包括闭塞的 上⽮状窦。在这种情况下,脑膜瘤往往是双侧⽮旁的。但是,如果上⽮状 窦仍然通畅,我们宁愿残留少量的窦旁肿瘤组织⽽避免损伤上⽮状窦。对 于少量残留的肿瘤组织我们可⾏术后随访或进⼀步采⽤⽴体定向放射治 疗。当然,过了较长⼀段时间后上⽮状窦可能完全闭塞,届时我们可以⾏ 再次切除。在上⽮状窦逐渐闭塞的过程中,有⾜够的时间建⽴静脉侧⽀循 环,不⾄于像术中或术后造成急性闭塞⽽引发不良后果。对于双侧⽮旁脑 膜瘤,如果术前上⽮状窦是通畅的,我们仅在肿瘤位于⽮状窦前1/3的情况 下才考虑闭窦。即使肿瘤位于⽮状窦前1/3,我们也应充分考虑到术后静脉 梗阻的可能性⽽慎重选择。除此以外,肿瘤周围⽪层的引流静脉均应完整 保留。
⽪肤切⼜及⾻瓣的设计应允许整个肿瘤充分暴露,较好能达到肿瘤外 缘⼏个厘⽶。肿瘤可以位于上⽮状窦单侧或双侧。即使是上⽮状窦单侧的 脑膜瘤,⾻瓣也应在跨中线⽽充分暴露肿瘤旁边的上⽮状窦。与凸⾯脑膜 瘤的切除相似,硬脑膜切开前就应悬吊于⾻窗周围。但对于⽮状窦单侧肿 瘤,为了避免桥静脉撕裂,近⽮状窦旁的硬膜不予悬吊。随后,在显微镜 下打开硬脑膜,从肿瘤外缘开始,从前、后两个⽅向向⽮状窦⽅向环形剪 开,靠近中线时⼀定要⾮常⼩⼼,避免损伤桥静脉。硬膜打开后,中线附 近以外的肿瘤⾎供应已切断。不幸的是,肿瘤的主要⾎供通常来⾃中线附 近。
下⼀步操作如何进⾏取决于肿瘤与上⽮状窦之间的解剖关系。如果术 前的影像提⽰肿瘤沿着⽮状窦⽣长⽽未侵及⽮状窦,我们可在⾼倍镜下, 沿中线⽮状窦外侧⼀点点剪开硬膜。需要注意的是,在这个过程中,要⼗ 分谨慎,每次只剪开⼀⼩段,这样⽐较容易控制局⾯。如果⽮状窦被意外 剪破,应⽴即缝合。缝合⽐⽤⾎管钳夹闭更顺利,因⽤⾎管钳夹闭时容易 滑脱。我们亦不建议使⽤双较电凝,因其可造成破⼜扩⼤。此处的硬膜切 开后,肿瘤的⼤部分⾎供即被切断了。接下来可⽤⽔分离和⼩脑棉寻找肿 瘤与⽪层之间的界⾯。需要强调的⼀点是,⽪层的正常引流静脉可能位于 肿瘤下⽅,⽽静脉与肿瘤之间通常都有⼀个明显的蛛⽹膜界⾯将两者分 开,我们应在⾼倍镜下沿着这个界⾯由肿瘤外侧向中线⽅向逐步分离。这 样的话,肿瘤通常可被整块切除,之后应在硬膜边缘检查是否有肿瘤残 留。硬膜的修补与凸⾯脑膜瘤⼀样,可⽤带蒂⾻膜⽚或⼈⼯硬膜。
对于侵⼊⽮状窦或在⽮状窦双侧⽣长的肿瘤,处理⽅式稍有不同。硬 膜由外侧向中线⽅向剪开,切除肿瘤之前亦应尽可能切断肿瘤的⾎供。
可以考虑⽤⽔分离寻找肿瘤与⽪层之间的界⾯,之后可在肿瘤边缘留 取缝线,⼀边轻轻提拉缝线,⼀边沿两者之间的界⾯逐步分离,这样有助 于保护界⾯处的正常引流静脉。当然,也可以先切除外侧部分肿瘤以获取 更⼤操作空间,之后可沿着⽮状窦将内侧部分肿瘤分离下来。对于⽮状窦 闭塞是双侧⽮状窦旁的肿瘤,在将肿瘤外侧部分完全分离后可考虑将 该段⽮状窦连同部分⼤脑镰⼀并切除。另⼀种做法是通过电凝沿着硬膜内 表⾯将肿瘤和硬膜分离,较终将肿瘤完全与硬膜分离,此时硬膜尚保留⽽ 翻向中线。接下来可⽤⽔和脑棉沿肿瘤与脑组织之间的界⾯将两者分离, 较终将肿瘤切除。肿瘤切除后腾出了更多的空间,可使我们更清楚看到周 围的⾎管结构,此时再⾏硬膜的切除就显得很⽅便了。硬膜切除后亦可以 ⽤带蒂⾻膜⽚或⼈⼯硬膜修补。
通常情况下,仅根据术前影像难以确定肿瘤的基底位置,只有在实际 ⼿术过程中才能明确肿瘤是起源于凸⾯硬膜还是⼤脑镰。在镰旁脑膜瘤切 除的过程中,有时甚⾄没有必要切除凸⾯的硬膜,所以也不⼀定要⾏硬膜 修补。当然,在⼀般情况下,我们倾向于为更复杂的情况做⼿术准备,然 后根据术中实际情况加以调整。 6.4.3 镰旁及天幕脑膜瘤的⼿术策略
3.镰旁脑膜瘤和天幕脑膜瘤的手术决策
不同于典型的凸⾯脑膜瘤,主要是由于它们 可能像上⽮状窦旁脑膜瘤侵⼊上⽮状窦⼀样⽽侵⼊到邻近的静脉窦如上⽮ 状窦和横窦。术前静脉期MRA,DSA或CTA检查有助于确定静脉窦通畅与 否。对于静脉窦通畅的病例,我们⼀般不予强⾏切除侵⼊静脉窦内的肿 瘤,⽽宁愿留到术后进⼀步⾏⽴体定向放射治疗。若强⾏切除侵⼊窦内的 肿瘤往往会损伤静脉窦或导致灾难性的静脉窦⾎栓形成。当然,如果术中 静脉窦损伤,需⽴即修补,否则可造成难以控制的⼤出⾎。需要指出的 是,即使术中静脉窦修补是成功的,⼏天后静脉窦⾎栓形成仍有可能发 ⽣。尽管上⽮状窦前1/3梗塞的风险较⼩,我们也很少切除。当然,如果该 段上⽮状窦在术前已经完全闭塞,予以切除也⽆妨。
与⽮旁脑膜瘤的切除相同,切⼜及⾻瓣的设计也应充分考虑肿瘤的位 置、⼤⼩,需充分暴露肿瘤及静脉窦,偏向肿瘤主体⼀侧。暴露充分的 好处很多,⾸先,术中意外损伤静脉窦时修补起来就容易得多;其次,⾏ 肿瘤切除时可以将⼤脑镰或⼩脑幕连同静脉窦轻轻推向对侧以便获取更⼤ 的操作空间。硬膜剪开的范围要稍⼤于肿瘤的范围,这样不仅利于在桥静 脉之间分离肿瘤,也利于更好的保护沿⽪层进⼊静脉窦的那些桥静脉。通 常,硬膜剪开的形状是“U”或“V”字形,基底朝向静脉窦。如果是⼤脑镰或 ⼩脑幕双侧脑膜瘤,⽽且肿瘤主要向⼩脑幕双侧⽣长,应在静脉窦双侧剪 开硬膜。当然,如果肿瘤仅在⼀侧⽣长,则在该侧剪开硬膜就⾜够了。此 外,如果肿瘤主体位于⼀侧⽽轻度向对侧⽣长造成静脉窦闭塞,单侧剪开 硬膜也是可以的。
硬膜剪开后⾸先要做的就是释放脑脊液以获得更⼤的操作空间。对于 镰旁脑膜瘤,这样做可以更好的进⼊纵裂,⽽对于天幕脑膜瘤,这样做可 以更好的进⼊⼩脑上池和四叠体池。操作的⽬标是,当不再牵拉脑组织时 可以完全看到位于⼤脑镰或⼩脑幕的肿瘤基底。切除肿瘤时,⾸先电凝肿 瘤基底并将肿瘤与基底处硬膜完全分离,这样可阻断⼤部分的肿瘤⾎供, 为此后的操作提供清楚的视野。接下来可部分切除肿瘤以获取更⼤的操作 空间,随后便可利⽤⽔分离法及脑棉沿肿瘤与脑组织间的界⾯进⾏分离。 当与肿瘤相连的蛛⽹膜、肿瘤的供⾎动脉及引流静脉都被电凝并切断后, 肿瘤或整块取出或分块取出,这取决于肿瘤体积及操作空间的⼤⼩,当然 也取决于桥静脉之间的间隙⼤⼩。在这个过程中,全部的过路⾎管及桥静脉均应设法保留。
肿瘤切除后,对肿瘤基底部硬膜的处理应充分考虑患者的年龄及静脉 窦是否通畅。如果静脉窦已经闭塞,我们通常选择切除肿瘤基底部硬膜及 局部闭塞的静脉窦,当然,在切除静脉窦之前,我们会在静脉窦的远、近 端各⾏⼏道结扎。如果静脉窦尚未闭塞,我们将沿静脉窦边缘外侧切除硬 膜。对于年龄较⼤的患者,或当残留的硬膜⾮常少时,我们可能扩⼤范围 电凝烧灼局部硬膜⽽不选择切除。电凝灼烧硬膜应采⽤钝头双较及较⾼功 率(我们⽤的Malis双较,功率调⾄50)。与⼤脑镰相⽐,⼩脑幕的暴露相 对困难,且其中有更多的静脉穿⾏,我们切除的相对较少。
对于双侧的脑膜瘤,切除的⽅式略有不同。通常有两种不同的选择。 其⼀,在⼤脑镰或⼩脑幕两侧分别处理肿瘤,处理⽅式如上所述,之后切 除⼤脑镰或⼩脑幕。其⼆,在肿瘤的前后缘直接电凝并切除⼤脑镰或⼩脑 幕,这样便同时离断了双侧肿瘤的⾎供,较终可将双侧的肿瘤连带基底⼀ 并切除。⼆种⽅法仅适⽤于静脉窦闭塞的情况。
硬膜如⽆缺损便可直接缝合,如果因切除静脉窦造成⼤的缺损,则可 ⽤⾻膜⽚或⼈⼯硬膜修补。⾻瓣的处理同凸⾯脑膜瘤⼀样,如果⽆肿瘤侵 犯则可还纳,如果受到肿瘤侵犯则应直接⾏颅⾻修补术。
4. 颅底脑膜瘤的⼿术策略
颅底脑膜瘤是全部脑膜瘤⾥较复杂的⼀种,可位于颅底的不同位置, 且通常与⼤的颅内动脉和颅神经及某些重要的脑组织关系密切。毫⽆疑 问,⼩的嗅沟脑膜瘤和⼤的岩斜脑膜瘤的⼿术⽅案相差迥异。处理起来, 每个部位的脑膜瘤都有其特定的解剖及功能要点,因篇幅有限,在此不能 ⼀⼀罗列,但我们尽可能地指出⼀些通⽤的要点。
对于⼤的甚⾄侵犯了⾎管及颅神经的颅底脑膜瘤,有些神经外科医⽣ 倾向于通过扩⼤暴露⽽追求⾼的肿瘤切除率,⽽另⼀些神经外科医⽣则根 本不愿意做这类⼿术。较近,我们的理念发⽣了变化,我们更倾向于通过 ⼩的、直接的暴露⽽达到部分切除肿瘤的⽬的,尽量避免激进的切除造成 术后颅神经功能受损。我们宁愿残留⼀些肿瘤组织,术后随访或进⼀步⾏ ⽴体定向放射治疗,也不愿意通过扩⼤暴露⽽获得稍⾼⼀点的肿瘤切除 率,因为我们很清楚,获得稍⾼肿瘤切除率的代价往往是患者术后的神经 功能障碍及并发症。较、较有经验的神经外科医⽣,即使是通过扩⼤ 暴露也不⼀定能够全切肿瘤,⽽这种激进的做法给患者带来的往往是严重 的神经功能障碍。与其这样,我们宁愿选择⼀种创伤⼩的⼊路⽽部分切除 肿瘤。如果有办法全切肿瘤⽽不⾄于造成严重并发症,我们当然会选择。 但是,对于⼤的、侵⼊静脉窦的颅底脑膜瘤,我们的处理就⽐较保守了。
⼿术⼊路的选择依脑膜瘤具体位置⽽定,需要较好地暴露肿瘤基底处 的硬膜及周围重要的⾎管及神经结构。多数情况下,肿瘤所在位置距离实 际开颅的位置还有相当⼀段距离,此时我们可以应⽤锁孔技术。
我们仅在⾏岩斜脑膜瘤切除时采⽤创伤较⼤的⼄状窦前⼊路,⽽对于 其他部位的肿瘤,我们⼀般都会选择合适的⼩创伤⼊路(详见5章)。
对于⼆次⼿术的病⼈,为了避免以往⼿术所致蛛⽹膜粘连⽽引起操作 困难,我们通常选择与以往不同的⼿术⼊路。
打开硬膜后,⾸先要做的就是从合适的脑池释放脑脊液,脑组织塌陷 后便可逐步分离到达肿瘤,此时操作的空间越来越⼤,瘤周的动静脉及颅 神经亦可清楚辨别了。直视下也可以看清楚重要的⾎管、神经等结构是被 肿瘤推移还是被肿瘤包裹,这就决定了的肿瘤切除⽅式。肿瘤表⾯的过路 ⾎管和神经均应仔细分离并严格保护。
在可视的范围内对基底部的脑膜瘤边电凝边切开,这样可以切断来⾃ 基底部的⾎供。如果肿瘤很⼤则难以辨别被肿瘤覆盖的周围结构,这时候 可以考虑分块切除肿瘤。分块切除肿瘤前⽤钝头双较电凝肿瘤组织(Malis 电凝调⾄50~70),之后予以吸除。双较电凝和吸引器的交替使⽤可避免 出⾎过多,此时超声吸引⼑很少使⽤。
⼀旦有⾜够的操作空间,可继续沿肿瘤表⾯分离,⽽⽔分离法则⽤来 进⼀步扩⼤肿瘤与脑组织间的间隙。与其他类型的脑膜瘤相⽐,颅底脑膜 瘤往往有来⾃于除肿瘤基底处硬膜之外的其他⾎供。术前的影像学检查常 可发现这些⾎供来⾃主要的颅内动脉或其分⽀。在⾼倍镜下仔细辨认肿瘤 的供⾎动脉和引流静脉,并以双较电凝后切断。如果这些⼩⾎管意外被撕 裂,则很快回缩⾄附近脑组织⽽很难辨认和⽌⾎。
肿瘤的⾎供切断后可根据实际解剖情况进⾏整块或分块切除。
对于颅底脑膜瘤,肿瘤基底处的硬膜我们不做常规切除,⽽是在肿瘤 切除后对其进⾏电凝灼烧(Malis双较调⾄50~70)。如果局部解剖条件合 适,对于肿瘤切除后⽣存期很长的病⼈,我们通常⽤尖头⼑或单较将肿瘤 基底处的硬膜切掉,⽽局部增⽣的⾻质则以⾦刚钻磨除。此外,如果⾻头 有渗⾎,可⽤⾦刚钻打磨⽌⾎。为了防⽌脑脊液漏,我们通常选⽤脂肪及 ⾻膜⽚、⼈⼯硬膜和纤维蛋⽩胶修补颅⾻及硬膜缺损。对于颅底的颅⾻缺 损,我们⼏乎不⽤⾻质移植物进⾏修补。较后⾏标准关颅。
5.肿瘤的质地
实际上,有些脑膜瘤的质地⾮常软,以⾄于可以⽤吸引器轻易吸除, ⽽有些脑膜瘤的质地⾮常硬以⾄于只能分成⼩块切除,⽽⼤部分脑膜瘤的 质地介于两者之间。直⾄⽬前,脑膜瘤的质地不能从术前MRI影像上准确 评估,⽽只有当肿瘤暴露时才能明确。质地硬的脑膜瘤较质地软的脑膜瘤 切除起来要困难得多,甚⾄连分块切除和电凝也显得相当棘⼿。对肿瘤进 ⾏细微的操作也可能导致肿瘤周围结构的损害。如果肿瘤质地很硬,术后 颅神经功能障碍的发⽣率要⾼。对于凸⾯脑膜瘤,肿瘤的质地并不重要, 但对于颅底脑膜瘤,肿瘤的质地直接关系到肿瘤的切除率,也决定了是否 要尝试更激进的切除。如果肿瘤质地很硬并侵犯了周围重要组织结构,且 可能侵⼊了静脉窦,在切除的时候较好保守⼀些,因为激进的切除可能导 致术后明显的神经功能障碍。⽽如果肿瘤质地很软,可以从⼀些重要结构 间的间隙中吸除,对于这样的肿瘤可考虑追求较⾼的切除率。需要进⼀步 指出的是,肿瘤的质地似乎说明不了肿瘤的分级。
6.脑膜瘤切除⼿术⼊路
对于凸⾯脑膜瘤,患者的体位和⼿术⼊路的选择原则是能够较好的暴 露肿瘤。我们常⽤的体位有仰卧位、侧卧位、半坐位以及俯卧位。⽽神经 导航的应⽤有助于确定切⼜和开颅的具体位置。当然,⽆论采取哪种体 位,⼀定要确定头部⾼于⼼脏平⾯,⽬的是降低出⾎量。
对于⽮旁及镰旁脑膜瘤,较常⽤的是仰卧位、半坐位及俯卧位结合纵 裂⼊路。较终体位的选择取决于肿瘤的前后⽅向,⽽较终⽬的是为术者提 供较放松的姿势,⽽与此同时也应确定肿瘤的前后缘都能暴露。
对于天幕脑膜瘤,我们通常采⽤侧卧位或坐位,前者适⽤于肿瘤主体 在幕上者,⽽后者结合⼩脑上-幕下⼊路则适⽤于肿瘤主体在幕下者。俯卧 位相对⿇烦,它要求患者下巴尽量屈曲向下⽽头部低于⼼脏平⾯,这样才 能获取幕下的良好视野。这个体位的不⾜之处是增加静脉性的出⾎⽽使⼿ 术难度增加。
对于全部的前颅窝、鞍旁、蝶⾻嵴脑膜瘤均采⽤外侧眶上⼊路;侵⼊ 中颅底的蝶⾻内侧型脑膜瘤需要采⽤外侧眶上⼊路,必要时要结合翼点⼊ 路或扩⼤颞部⾻瓣;颞下⼊路适⽤于海绵窦外侧壁脑膜瘤及中颅底前部及 中部的脑膜瘤;采⽤⼄状窦前⼊路切除岩斜脑膜瘤时通常需要去掉部分岩 ⾻;⽽CPA脑膜瘤则采⽤⼄状窦后⼊路切除;对于枕⼤孔区脑膜瘤则通常 采⽤外侧⼊路就⾜够了,所以较少采⽤坐位结合低正中⼊路。
7.切断⾎供
切断肿瘤的⾎供对于全部的脑膜瘤切除⼿术都是⾄关重要的。如前所 述,⼤多数肿瘤的⾎供来⾃肿瘤基底处的硬脑膜。因此,这⾥是我们⾸先 应该处理的地⽅。对于颅底、镰旁及天幕脑膜瘤来讲,较好的⽅法是双较 电凝肿瘤基底处的硬膜,逐步分离,较终将整个肿瘤从基底处硬膜完全剥 离下来。这种切除⽅式同样适⽤于凸⾯和⽮旁脑膜瘤,但这样做需要花费 更多的时间,并且与将肿瘤周围硬膜切开相⽐没有任何优势。在显微镜下 操作可以避免对⽪层⾎管和过路⾎管不必要的损伤。⼀般情况下,绝⼤多 数的⾎管都在肿瘤下⽅的⽪层表⾯,但在靠近中线处也可能有⾎管覆盖在 肿瘤表⾯。
肿瘤基底部硬膜处理结束后,其余肿瘤的⾎液供应将来⾃肿瘤周围⼤ ⼤⼩⼩的穿⽀动脉。在凸⾯脑膜瘤,这种类型的供⾎⽐其他类型的脑膜瘤 少见。这种类型的穿⽀供⾎在⼤的脑膜瘤更为常见。这⾥的窍门是⾼倍镜 下,沿肿瘤表⾯分离确认全部的供⾎动脉及引流静脉,电凝并切断后再⾏ 进⼀步分离。需要指出的是,对于这些⾎管,单纯的电凝往往是不够的, 因为在牵拉肿瘤的过程中可能造成这些⾎管的意外撕裂,这些⼩⾎管撕裂 后可能回缩到脑组织中⽽继续出⾎。在⼀个⼤的操作空间⾥,它可能会回 缩到某个死⾓⽽使⽌⾎变得⾮常困难。只有为了必要的减压我们才切开肿 瘤。双较电凝和吸引器的交替使⽤可以减少出⾎量,所以我们⼀般不⽤超 声吸引⼑。如果肿瘤较⼤且⾎供丰富,术前栓塞肿瘤可能是有益的。与动 静脉畸形⼿术相似,我们应该尝试栓塞那些⼩的穿⽀动脉⽽不是⼤的供⾎ 动脉,因为⼤的供⾎动脉在⼿术过程中⽐较容易处理。
8. 肿瘤切除
分离脑膜瘤时较重要的是要正确找到肿瘤和脑组织之间的间隙。有时 候,很容易在肿瘤与脑组织之间找到⼀层清晰的蛛⽹膜界⾯,分离起来就 ⽐较简单了。但有时候肿瘤与脑组织紧紧粘连,分离起来就相对困难了。 在分离肿瘤的时候,我们⾮常多地使⽤⽔分离法,能够将肿瘤与其周围组 织分开,并能很好地保护⼩的动脉和静脉,如果是供⾎⾎管则予以电凝切 断,如果是过路⾎管则予以保留。
我们从肿瘤与⽪层间蛛⽹膜界⾯⽐较清晰的地⽅开始分离。⽤⽔分离 法找到蛛⽹膜界⾯后,⽤钝针头沿着这个界⾯注射⽣理盐⽔,这样就能将 肿瘤与⽪层分离开来,不断扩⼤蛛⽹膜界⾯。然后在⾼倍镜下将暴露出来 的供⾎动脉及粘连的蛛⽹膜电凝后切断,空间⾜够的时候塞⼊⼩脑棉,如 此重复,沿着肿瘤的整个表⾯逐步分离。需要注意的是,分离的过程中应 推压肿瘤⽽尽可能少地牵拉脑组织。当然,我们在推压肿瘤的同时,肿瘤 也会对对侧的脑组织造成压迫,如果脑组织有⽔肿,这种压迫就更为明 显。在这种情况下,通过释放脑脊液和部分切除肿瘤减压可以减少对脑组 织的压迫。切除脑膜瘤的时候,务必在正常脑组织之外操作。
即使要分块切除肿瘤,我们⾸先⼀定要沿界⾯分离肿瘤并切断⾎供, 之后才能⽤显微剪剪掉⼀块。除⾮肿瘤质地特别硬,否则我们不⽤带圈双 较电凝(Loop),因为根据我们的经验,带圈双较电凝(Loop)会造成明 显的热传导⽽容易损伤周围的神经元和⾎管结构。此外,分块切除肿瘤可 能造成切⾯的出⾎,⽽⽌⾎往往需要花费很多的时间。
在肿瘤与神经或重要⾎管粘连的地⽅,⾼倍镜下的锐性剥离可以更好 的保护神经或重要的⾎管结构。为了保护⼀个过路动脉可能会使⼀个简单 的凸⾯⼩脑膜瘤切除变得费时费⼒,但我们认为这样做是值得的,加以时 间和经验,它也将变得越来越容易。
肿瘤切除后,应仔细检查瘤腔内是否有肿瘤残余并严格⽌⾎。较后, 瘤腔壁上以速即纱覆盖,有时要⽤到纤维蛋⽩胶。
9.修补硬膜
对于颅底和⼤脑镰脑膜瘤,我们⼀定要权衡切除肿瘤基底部硬膜的利 弊。如果颅底硬膜缺损较⼤就存在脑脊液漏的可能,此时我们会尝试⽤⾻ 膜或⼈⼯硬膜修补。颅底⾻质及硬膜缺损越⼤,术后脑脊液漏的风险也就 越⼤。
对于凸⾯脑膜瘤,我们开颅的时候准备⼀个带蒂⾻膜瓣,关颅的时候 可直接连续缝合在硬膜缺损处作硬膜修补。当然,有时候我们也会使⽤⼈ ⼯硬膜进⾏修补,这样省去了准备带蒂⾻膜瓣的时间。需要指出的是,⼈ ⼯硬膜的⽔密性较差,尽管采⽤了不同的缝合⽅式,我们还是遇到了⼀些 术后⽪下积液的病例。这些病例多数可以通过加压包扎治愈,但有⼀些可 能需要腰穿引流数⽇才能解决。
10.疑难脑膜瘤手术案例展示
·多发脑膜瘤,经德国巴特朗菲教授手术后3年没有复发
简要病史:突发癫痫就医,MRI检查后发现大脑左额镰旁有肿瘤占位,部分切除后活检结果是“脑膜瘤”。术后行伽玛刀治疗无效,再次MRI检查显示大脑镰前段基本均受累,并有大脑镰右侧肿瘤生长,矢状窦被累及,左侧额部凸面硬脑膜多处肿瘤生长。这代表病情进一步恶化成了多发脑膜瘤。
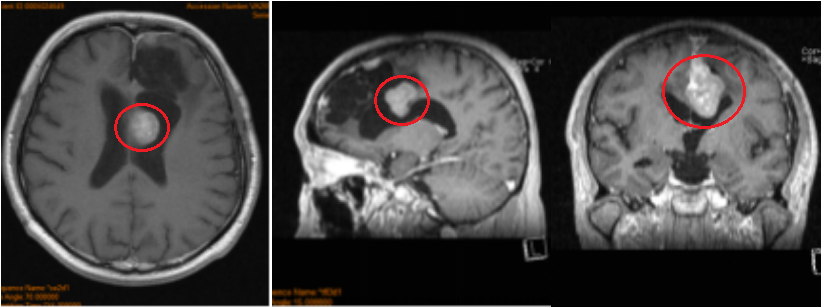
术前:左额凸面及前段大脑镰多发脑膜瘤被全部切除;前 1/3 矢状窦被切除;前段大脑镰被切除;左额硬脑膜被大部分切除,无硬脑膜强化表现。左额术后侧脑室额角穿通。
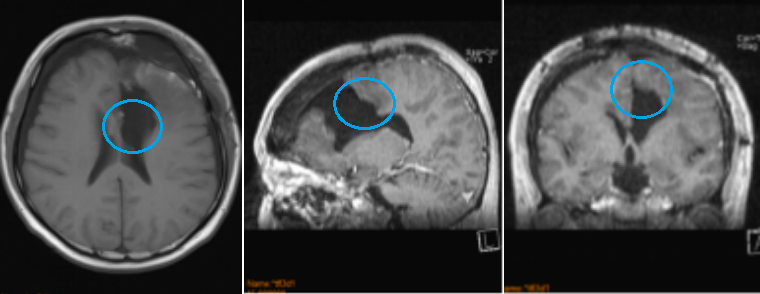
术后:左额凸面、及前段大脑镰多发脑膜瘤被全部切除;前 1/3 矢状窦被切除;前段大脑镰被切除;左额硬脑膜被大部分切除,无硬脑膜强化表现。左额术后侧脑室额角穿通。术后ICU观察一天,术后二天下床进行康复锻炼。神经功能无任何异常。术后3年没有复发。
·较大脑膜瘤全切术后1年半,没有复发无后遗症
简要病史:王女士,60+岁,检查出有“左侧额部大脑镰旁脑膜瘤”,由于肿瘤不到3cm加上无症状,前沿行了保守治疗。2018年复查,脑膜瘤已大于5cm,逐渐出现肢体无力,复查MR显示肿瘤侵犯静脉窦、压迫功能区。
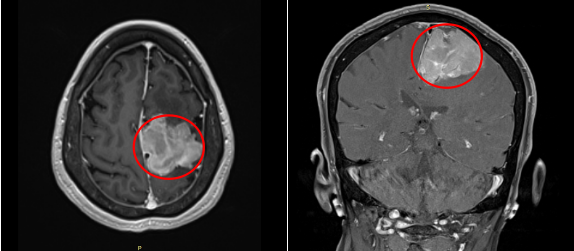
术前:脑膜瘤钙化和瘤周压迫、水肿效应明显,且已侵袭矢状窦,压迫运动功能区。
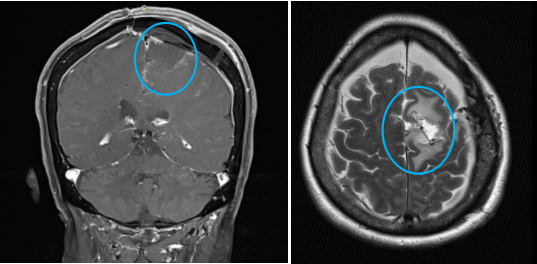
术后:肿瘤肉眼下全切,可见局部组织缺陷,水肿效应存在,被压迫正常脑组织缓慢复位。运动功能区无损伤。术后当天即拔插管,术后1天迁出ICU,术后2天可以在护理人员搀扶下走路康复训练,术后5天已经可以独自走路,无需陪同,肢体肌力明显好转,术后1周+,恢复地和正常人一样,精神状态很好。术后1年半,没有复发无后遗症。
资料来源:Helsinki Microneurosurgery Basics and Tricks.
- 文章标题:脑膜瘤如何手术?不同位置脑膜瘤的手术方案分析
- 更新时间:2021-03-24 16:50:34

 400-029-0925
400-029-0925